Essay
Bioingeniører i forskning: Kan blod fra trente personer hjelpe pasienter med Alzheimer?
I et forsøk på å forstå hvorfor trening har en gunstig effekt på hjernen, har forskningen ledet oss hele veien fra nevroner i cellekultur, til en klinisk legemiddelstudie for Alzheimer-pasienter. Bioingeniører har hatt sentrale roller hele veien.
Da Cardiac Exercise Research Group (CERG) startet å eksperimentere med om trent blod (ExPlas) kunne ha et behandlingspotensial i 2015, var det i en tid hvor nye funn utfordret etablerte forestillinger om hjernens isolasjon fra resten av kroppen.
I studier fra universitetene Stanford og Harvard i USA viste forskere at blod fra unge mus kunne virke foryngende på hjernen til eldre mus. Dette utfordret den gjeldende forståelsen om at kun et fåtall stoffer kunne passere fra blodet til hjernen. Tidligere var det antatt at sirkulerende faktorer hadde begrenset betydning for hjernens funksjon, og at blod–hjerne-barrieren i stor grad begrenset påvirkning fra systemiske signaler.
Plutselig ble det tydelig at signalstoffer, proteiner og andre molekyler i blodet faktisk kan spille en direkte rolle i hvordan hjernen eldes.
Ved Stanford hadde Saul Villeda og hans kolleger (1) koblet sammen unge og eldre mus – rett og slett sydd dem sammen – slik at kapillærene vokste sammen og de fikk felles blodsirkulasjon, såkalt parabiose.

Dette ga opphav til flere studier som viste at aldrende hjerner fikk økt nydannelse av nerveceller i hjernen, såkalt nevrogenese, når de fikk blod fra yngre mus. Særlig så forskerne dette i hippocampus – et område som er viktig for hukommelse og læring.
De observerte også forbedret synaptisk plastisitet, hjernens evne til å styrke eller svekke forbindelser mellom nerveceller basert på aktivitet. Samlet førte dette til bedret kognitiv funksjon hos de eldre dyrene som hadde mottatt ungt blod.
Disse funnene la grunnlaget for de første kliniske forsøkene på mennesker, der blant annet pasienter med Alzheimers sykdom ble behandlet med plasma fra unge blodgivere. Resultatene fra disse tidlige studiene viste at behandlingen var trygg og ble godt tolerert (2). Det åpnet for videre utforskning av blodbaserte behandlingsstrategier mot nevrodegenerative sykdommer.
Fysisk aktivitet og demens
Parallelt vokste det frem en annen forståelse: at fysisk aktivitet har dype og systemiske effekter på hjernen. Fysisk form ble ikke lenger sett på kun som et mål på hjerte- og karhelse, men ble i økende grad fremhevet som en buffer mot kognitiv svikt og demens.
Fysisk aktive individer har lavere risiko for en rekke sykdommer, muligens inkludert Alzheimers sykdom. Samtidig visste vi at kondisjon er en reversibel faktor, som betyr at selv eldre og inaktive kan, med riktig trening, forbedre både hjerte- og hjernehelse.
Sammenhengen mellom kondisjon og demensrisiko er også støttet av nyere befolkningsbasert forskning. I en studie publisert i The Lancet Public Health (3) analyserte vi data fra Helseundersøkelsen i Trøndelag (HUNT), der over 30 000 deltakere ble fulgt i opptil 30 år.
Vi fant at personer med høy kondisjon over tid hadde om lag 40 % redusert risiko for å utvikle demens, sammenlignet med dem med vedvarende lav kondisjon. Risikoen var også betydelig lavere blant dem som forbedret kondisjonen sin i løpet av oppfølgingsperioden. Studien viste dessuten at god kondisjon var assosiert med redusert risiko for demensrelatert død, og at forbedret kondisjon kunne gi to–tre ekstra leveår uten demens.
Dette støttes av dyremodeller som viser at fysisk aktivitet, særlig utholdenhetstrening, fører til økt produksjon av nerveceller i hippocampus. Trening øker både nervecellenes proliferasjon og overlevelse.
Trening er også forbundet med økt synaptisk plastisitet, en prosess som er sentral for læring og hukommelse. I flere studier har man observert at fysisk aktivitet hos eldre dyr kan motvirke aldersrelatert nedgang i nevrogenese og kognitiv funksjon.
I tillegg til lokale effekter i hjernen, har det blitt tydelig at trening også påvirker hjernen indirekte gjennom endringer i det systemiske miljøet. Under fysisk aktivitet øker blodtilførselen til hjernen, og treningen setter i gang en rekke systemiske prosesser som gir opphav til sirkulerende faktorer i blodet – såkalte exerkines eller treningsmolekyler.
Disse ser ut til å krysse blod–hjerne-barrieren eller signalisere til områder i hjernen der nye nerveceller dannes.
Bioingeniørkompetanse er etterspurt langt utover rutinediagnostikk
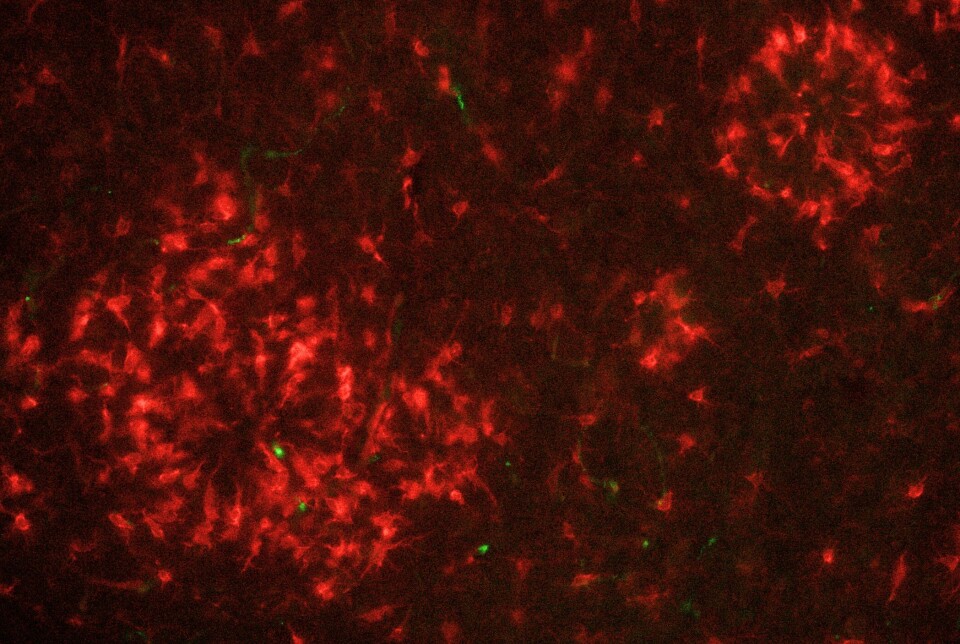
Nyfødte nevroner i hippocampus dannes i nærheten av blodkar, og reagerer direkte på vekstfaktorer i blodsirkulasjonen. Studier har vist at en del av den aldersrelaterte nedgangen i nevrogenese og kognitiv funksjon kan knyttes til endringer i blodbårne faktorer, og at disse kan moduleres gjennom fysisk aktivitet (4)(5). Trent plasma påvirket mikrogliaenes form og immunprofil hos Alzheimer-rotter, med størst effekt når behandlingen ble startet tidlig i sykdomsforløpet (6).
Ex-Plas blir født
I denne sammenhengen vokste ExPlas-ideen frem:
Hvis ungt blod kan påvirke aldrende hjerner – hva med trent blod? Kan faktorene i blodbanen som utløses av trening virke som «egenprodusert medisin»?
Vi ønsket derfor å undersøke om trening kunne forandre blodets sammensetning på en måte som kunne komme hjernen til gode – også hos personer som allerede var i risikosonen for demens.
ExPlas er dermed det første kliniske prosjektet i verden som tester om intravenøs behandling med plasma fra unge, svært godt trente blodgivere kan påvirke hjernen hos personer med Alzheimers sykdom (7).
Studien gir en unik mulighet til å undersøke hvordan trening kan omsettes til biologisk behandling – og hva som faktisk skjer i hjernen når blod fra unge, trente personer tilføres pasienter med Alzheimers sykdom.
Prosjektet er forankret i en tverrfaglig innsats der hjerte, kar og hjerne ikke lenger ble sett som separate systemer, men som tett sammenvevde deler av én helhetlig fysiologi, der blodet utgjør den avgjørende forbindelsen.
Fra idé til celleforsøk
En cellemodell ble utviklet for å teste hypotesen, og det ble etablert en protokoll for å simulere Alzheimer-lignende stress i hjerneceller isolert fra hippocampus hos mus. Formålet var å undersøke hvordan plasma fra trente og utrente personer påvirket cellenes respons på toksisk belastning.
Cellene ble utsatt for Alzheimer-lignende patologi med et fragment av det toksiske peptidet amyloid-β, før de ble behandlet med enten plasma fra godt trente personer, eller plasma fra utrente personer.
Resultatene var oppsiktsvekkende: Plasma fra trente personer klarte signifikant bedre enn plasma fra utrente personer å motvirke den skadelige effekten av amyloid-β, og bedret cellenes levedyktighet (8).
Veien videre: Fra celler til dyremodell
Det neste steget var å teste hypotesen i en dyremodell. I samarbeid med forskere ved Kavli-instituttet ved NTNU gjennomførte CERG-gruppen en studie der rotter med Alzheimer-lignende endringer i hjernen ble behandlet med plasma fra unge, trente rotter. Kontrollgruppene fikk plasma fra utrente rotter eller saltvann.
Ved injeksjon av plasma fra trente rotter ble det observert en markant økning i nevrogenese hos rotter med Alzheimers-lignende endringer i hjernen – sammenlignet med de som fikk saltvann eller plasma fra utrente kontroller (8). Det var godt dokumentert i dyremodeller at god kondisjon stimulerer dannelsen av nye nerveceller i hippocampus.
Det som gjorde funnene særlig oppsiktsvekkende, var at samme effekt kunne utløses uten at dyrene selv trente. Dette tyder på at fysisk aktivitet kan endre blodets innhold på en måte som direkte påvirker hjernen, også i en sykdomstilstand. Funnene styrker ideen om at blodbårne signalstoffer utløst av trening kan ha terapeutisk potensial, og åpner for en ny tilnærming til behandling av nevrodegenerative sykdommer.
ExPlas – en klinisk legemiddelstudie
Neste steg - utprøving på mennesker - krevde grundig planlegging, godkjenning fra Regional komité for medisinsk og helsefaglig forskningsetikk (REK) og Legemiddelverket, samt etablering av nye rutiner og samarbeid på tvers av fagmiljøer.
Siden prosjektet ble definert som en legemiddelstudie, tok det over to år fra første søknad ble sendt, til endelig godkjenning forelå.
Legemiddelstudien er et tverrfaglig samarbeid mellom forskningsgruppen CERG, nevrologisk avdeling, blodbanken og hjerteavdelingen ved St. Olavs hospital – samt en rekke teknikere, sykepleiere, forskere, leger og bioingeniører både ved sykehuset og NTNU. Vi er nærmere 60 personer som jobber med driften av studien.
Gjennomføringen av en studie av dette omfanget er krevende, og stiller høye krav til både faglig kompetanse, forståelse for kliniske rutiner og evne til praktisk problemløsning. Et slikt prosjekt forutsetter også et sterkt engasjement og en løsningsorientert tilnærming hos de involverte – noe som har vært avgjørende for fremdriften.
Hva skjer i blodet under trening?
Parallelt med den kliniske studien arbeides det iherdig med å forstå hva det faktisk er i blodet som formidler de gunstige effektene av trening. Selv om det er antatt at det ikke dreier seg om ett enkelt stoff, men snarere en kompleks blanding av signalmolekyler, såkalte treningsmolekyler, vet vi ennå ikke nøyaktig hvilke faktorer som er sentrale.
Å kartlegge disse molekylære endringene i blodet etter trening, er derfor en sentral del av forskningen vår.
Relevans for samfunnet
Med en aldrende befolkning og økende forekomst av nevrodegenerative sykdommer, er det et presserende behov for nye og målrettede strategier for forebygging og behandling.
Vi vet samtidig at fysisk aktivitet ikke bare virker forebyggende over tid, men også har umiddelbare fordeler for mental helse, som bedre søvn, redusert stress og økt livskvalitet. Likevel opplever mange at dagens aktivitetsanbefalinger – 150 minutter med moderat eller 75 minutter med intensiv fysisk aktivitet per uke – er vanskelige å følge. Tidsmangel er blant de vanligste årsakene til at folk ikke trener.
Nyere forskning viser at også kortere treningsøkter med høyere intensitet kan gi betydelige helsegevinster. For å formidle dette på en tilgjengelig måte og senke terskelen for å komme i gang, har Atefe R. Tari og kollega Ulrik Wisløff gitt ut boken Mikrotrening. Den bygger på denne forskningen, og viser hvordan korte, effektive økter kan gi stor gevinst – også for hjernen.
Gjennom prosjekter som ExPlas forsøker vi å bidra med ny innsikt i hvordan fysisk aktivitet kan brukes som presisjonsforebygging, også i sårbare grupper.
Koblingen mellom fysisk form og hjernehelse ble ytterligere utdypet i en oversiktsartikkel nylig utgitt i The Lancet (9). Der presenterte vi sentrale nevrobiologiske mekanismer som forklarer hvordan kondisjon og utholdenhetstrening påvirker aldringsprosesser i hjernen. Oversikten fremhever hvordan trening kan bidra til økt blodstrøm, redusert inflammasjon og bedre cellulær plastisitet – og understreker betydningen av kondisjon som en beskyttende faktor mot demensutvikling.
Samtidig ønsker vi å synliggjøre hvilke spennende muligheter som finnes for bioingeniører som er nysgjerrige på forskning. Tverrfaglige prosjekter som dette trenger folk med teknisk og analytisk kompetanse, samt engasjerte fagpersoner som vil bidra til ny kunnskap og bedre folkehelse.
Bioingeniører spiller en nøkkelrolle i alle faser av et forskningsprosjekt, og ExPlas er et godt eksempel på hvordan vår kompetanse som bioingeniører er helt avgjørende i alt fra planleggingsfase til publiserte resultater. For bioingeniørstudenter som vurderer en forskerkarriere, er det viktig å vite at det finnes mange veier inn.
Bioingeniørkompetanse er etterspurt langt utover rutinediagnostikk, enten det handler om avanserte analyser, metodeutvikling eller forskningsdesign.
Når inklusjonsperioden i ExPlas-studien nå nærmer seg slutten, må vi vente ett år før alle deltakerne har fullført behandlingen. Deretter kan vi avblinde studien og analysere effekten av behandlingen.
Parallelt jobber vi med å finne ut hva det er i blodet fra trente personer som kan gi en positiv effekt, også hos pasienter. Vi har allerede identifisert flere lovende kandidatmolekyler, og disse planlegger vi nå å teste i ulike modeller, blant annet i hjerneorganoider laget fra pasienter med Alzheimer.
Målet er å forstå de biologiske mekanismene bak effekten, og på sikt utvikle nye, målrettede behandlinger.
Referanser
- Villeda SA, et al. The ageing systemic milieu negatively regulates neurogenesis and cognitive function. Nature. 2011: p. 90-94.
- Sha SJ, et al. Safety, Tolerability, and Feasibility of Young Plasma Infusion in the Plasma for Alzheimer Symptom Amelioration Study: A Randomized Clinical Trial. JAMA Neurology. 2019: p. 35-40.
- Tari AR, et al. Temporal changes in cardiorespiratory fitness and risk of dementia incidence and mortality: a population-based prospective cohort study. The Lancet Public Health. 2019: p. 565-574.
- Tari AR, et al. Are the neuroprotective effects of exercise training systemically mediated? Progress in Cardiovascular Diseases. 2019 Mar: p. 94-101.
- Huuha AM, et al. Can exercise training teach us how to treat Alzheimer's disease? Ageing Research Reviews. 2022 Mar.
- Huuha AM, et al. Effects of Intravenously Administered Plasma from Exercise-Trained Donors on Microglia and Cytokines in a Transgenic Rat Model of Alzheimer's Disease. Brain plas. 2024: p. 21-41.
- Tari AR, et al. Safety and efficacy of plasma transfusion from exercise-trained donors in patients with early Alzheimer's disease: protocol for the ExPlas study. BMJ Open. 2022.
- Norevik CS, et al. Exercised blood plasma promotes hippocampal neurogenesis in the Alzheimer's disease rat brain. Journal of Sport and Health Science. 2024 Mar: p. 245-255.
- Tari AR, et al. Neuroprotective mechanisms of exercise and the importance of fitness for healthy brain ageing. The Lancet. 2025 Mar: p. 1093-1118.






























