FAG Kronikk

Er analysesvarene mer pålitelige i dag enn for 50 år siden?
For 50 år siden, i 1966, publiserte Kjell Rootwelt og Bjørg Nesvik en artikkel i Fysiokjemikeren hvor de i overskriften stiller spørsmål ved påliteligheten til analysesvar fra norske klinisk kjemiske (i dag medisinsk biokjemiske) laboratorier (1). Jeg ble ansatt i Norsk Klinisk-kjemisk Kvalitetskontroll (NKK) i 2006, for ti år siden. I løpet av disse årene har jeg hatt anledning til å følge utviklingen av analysekvaliteten på medisinsk biokjemiske analyser og samtidig fått en del erfaring og kunnskap innen dette fagområdet. Derfor var det både spennende og artig å lese denne artikkelen, som er basert på studien som bidro til dannelsen av NKK.
Bakgrunn
Bakgrunnen for studien var blant annet en undersøkelse forfatterne selv utførte i 1962 blant 84 norske sykehus, for å kartlegge utbredelsen av de viktigste medisinsk biokjemiske analysene (2). Resultatene viste at flere viktige analyser hadde liten utbredelse og at «pasienter i en rekke fylker var avskåret fra å bli ytet fullgod klinisk kjemisk service i en rekke akutte situasjoner» (sitat). Undersøkelsen avdekket ikke om analysene ble utført med tilstrekkelig god analysekvalitet. Da flere utenlandske undersøkelser gjort på samme tid, viste dårlige resultater for analysekvalitet (3-6), ble det bestemt å gjennomføre en studie for å undersøke dette nærmere i norske laboratorier. Samtidig ønsket man å hjelpe det enkelte laboratorium med å evaluere egne prestasjoner og oppdage analysefeil.
Studien og artikkelen fra 1966
To ulike sera (kontroll X og Y) som var ulike fortynninger av seronorm (et stabilisert, frysetørret hesteserum) ble sendt ut til 57 større sykehus. Laboratoriene ble bedt om å utføre følgende 13 analyser: protein, ASAT, urea, kreatinin, fosfat, kalsium, natrium, kalium, klorid, bilirubin, kolesterol, glukose og jern. Konsentrasjonen av hver av de ulike komponentene var fastlagt i samarbeid med Nyco (produsent av kontrollene) og fire nordiske laboratorier. Analysene skulle utføres som rutineundersøkelser, men med den forskjell at hver analyse skulle utføres så mange ganger serummengden rakk. Gjennomsnitt, standardavvik (SD) og variasjonskoeffisient (CV) ble beregnet for totalt antall innsendte resultat for hver komponent for hvert av de to sera. I tillegg ble gjennomsnitt av målingene for hver komponent på det enkelte sykehus, beregnet som prosentvis positivt eller negativt avvik fra den korrekte/ «sanne» verdi (bias). Basert på sistnevnte resultater ble det tegnet spredningsdiagram for hver komponent. Langs x-aksen var sykehusets prosentavvik fra kontroll X’s korrekte verdi - og langs y-aksen prosentavvik fra kontroll Y’s korrekte verdi. Hvert sykehus ble vist som et punkt i diagrammet. Grenser for bias var tegnet inn i diagrammet. Disse var basert på biologisk variasjon (Bias ≤ 0,25 CVbio.total) (4), men justert dersom biologisk variasjon var spesielt liten eller stor. Generelt aksepterte feilgrenser for bias fantes ikke den gang og begrunnelsen for valg av grenser var at kvaliteten må være så god at det er mulig å skille mellom normale og patologiske verdier.
En gal analyse er verre enn ingen analyse i det hele tatt.
40 av 57 inviterte sykehus deltok (70 %). Resultatene for glukose og ASAT viste så stor negativ bias, antakelig på grunn av for lang henstand, at resultatene ble ekskludert. Resultatene for de andre komponentene viste stor spredning, og CV varierte fra 3,2 % (natrium) til 33,3 % (bilirubin). 35,8 % av analyseresultatene totalt hadde uakseptabel kvalitet (lå utenfor feilgrensen) og 7,3 % lå utenfor 3 x feilgrensen. Gjennomsnittsverdiene for de ulike komponentene lå imidlertid nær den korrekte verdien med to unntak; bilirubin og kalsium. Det ble også undersøkt om det hadde noen betydning for påliteligheten av analysesvar om sykehuset hadde en spesialist i medisinsk biokjemi som leder på laboratoriet. Resultatene tydet på det. 16 av de 40 sykehusene hadde spesialist, mens 24 hadde medisinsk overlege som ansvarlig for laboratoriedriften. Førstnevnte gruppe hadde 70,4 % analyser med tilfredsstillende riktighet og presisjon, sammenlignet med 33,8 % for sistnevnte.
Artikkelen konkluderer med at analysekvaliteten var skremmende dårlig og at spredningen mellom sykehusene var større enn hva som kunne anses som forenlig med forsvarlig sykehusdrift. «Selv halvparten av sykehusene greidde ikke engang halvparten av analysene på en tilfredsstillende måte» (sitat). Forfatterne mente det var medisinsk påkrevd at man ofret både tid og penger for å oppnå bedre kvalitet. «En gal analyse er verre enn ingen analyse i det hele tatt, fordi den kan villede klinikeren» (sitat).
Kommentarer til studien
Artikkelen er velskrevet og beskriver en spennende studie som på mange måter kan sammenlignes med hvordan et EKV-program (EKV = Ekstern Kvalitetsvurdering) gjennomføres i dag. Studien må kunne ansees som et pionerarbeid som var med å danne grunnlaget for ekstern kvalitetsvurdering i Norge.
Det er flere nøkkelfaktorer som er avgjørende for nytteverdien/kvaliteten til et EKV-program: Hvilket kontrollmateriale som er benyttet, hvordan tillagt verdi er etablert, antall replikater av EKV-prøven, og hvilke akseptgrenser som benyttes (7). Den viktigste egenskapen til kontrollmaterialet er kommutabilitet (at det oppfører seg som et vanlig pasientmateriale), og betydningen av dette er noe man er blitt mer og mer klar over i senere år (8, 9). Hvis et materiale ikke er kommutabelt, finnes en «matrikseffekt», det vil si en uønsket fordreining av analyseresultatet som tilskrives fysiske og kjemiske forskjeller i prøvematerialet, sammenliknet med det pasientmateriale som analysene er innrettet mot. Man har for en stor del forlatt bruken av animalske sera og kjemisk stabiliserte sera på grunn av erfaringer med matrikseffekter (10). Også forsiktig tilsetning av komponenter for å øke analyttkonsentrasjoner (spiking), samt frysetørking, er forbundet med matrikseffekter (10). Den ideelle EKV-prøven har to viktige egenskaper; den er kommutabel og har en tillagt verdi etablert med en referansemetode med liten usikkerhet. Hvis ikke begge disse to kriteriene er oppfylt, kan feiltolkinger av EKV-resultater oppstå, noe som genererer kostnader for laboratoriet uten å gi nytteverdi.
Analysesvarene fra norske medisinsk biokjemiske laboratorier var ikke å stole på i 1966.
I studien ble det benyttet et stabilisert, frysetørret hesteserum, som i tillegg ble «spiket» med en del komponenter. Det er grunn til å tro at dette materialet ikke var kommutabelt, og dermed kunne gi annerledes bias mellom analysemetoder og instrumenter enn det en pasientprøve ville gitt. Tillagt verdi var en konsensusverdi fastlagt i samarbeid med Nyco og fire nordiske laboratorier – altså ikke en referanseverdi, men et godt alternativ og det beste man kunne få til på den tiden. Noen av sykehusene kan ha fått et «urettferdig» stort avvik som skyldtes ikke kommutabelt kontrollmateriale, noe som eventuelt ikke var laboratoriets ansvar. Hadde man hatt den kunnskap man har i dag, ville trolig sykehusene i denne studien blitt delt inn i metodegrupper og resultatene sammenlignet mot en metodespesifikk tillagt verdi. Artikkelen sier ikke noe om hvilke og hvor mange metoder som var i bruk på den tiden. Det at gjennomsnittsverdiene for de fleste komponenter ikke avvek så mye fra den korrekte verdien, kan tyde på at metodene som var i bruk var ganske like (hadde like måleprinsipp). Hovedproblemet var den store spredningen av analyseresultater totalt for den enkelte komponent. Det ble ikke gjort noen presisjonsvurdering av det enkelte sykehus/laboratorium basert på replikatmålingene, men det ble beregnet en total CV for hver komponent basert på alle resultatene samlet. En årsak til den store spredningen kan være at metodene ikke var særlig robuste, og at de hadde en del manuelle trinn som gjerne ble utført forskjellig på ulike sykehus. Replikatmålingene utført på hvert laboratorium kunne vært brukt til å beregne en «innen laboratorie-CV» for de enkelte komponenter, noe Norsk Kvalitetsforbedring av Laboratorievirksomhet Utenfor Sykehus (Noklus) i dag gjør i mange av sine EKV-program (11). Den grafiske fremstillingen av resultatene (scatterdiagrammene) er lik de Youden-plott som i dag brukes i EKV-rapporter, hvor man har to prøver i ulike nivå. En forskjell er at man i Youden-plottet har konsentrasjon på X- og Y-aksen, og ikke prosent avvik fra fasitverdi. Scatterdiagrammet gir et godt bilde på analysekvaliteten for den enkelte komponent, både med hensyn til presisjon og riktighet, og det er enkelt for laboratoriet å vurdere egen bias. Akseptgrensene i studien var basert på biologisk variasjon, noe som kan være strengt da materialet sannsynligvis ikke var kommutabelt og alle resultatene ble vurdert mot en felles fasitverdi.
Veien videre – NKK blir til
Svaret på spørsmålet som ble stilt i tittelen på artikkelen fra 1966 må bli NEI – analysesvarene fra norske medisinsk biokjemiske laboratorier var ikke å stole på i 1966. Publisiteten rundt de dårlige resultatene skapte grobunn for en bred faglig innsats for å bedre analysekvaliteten og dette ble starten på ekstern kvalitetsvurdering i Norge (12). På slutten av 1960-årene ble det organisert gjentagende norske screeninger med ukjente kontroller for 30-35 laboratorier, men kun for de med laboratorieoverlege. At kun disse fikk delta var sannsynligvis en følge av resultatene fra studien, som viste at analysekvaliteten gjennomsnittlig var bedre dersom laboratoriene hadde spesialist i medisinsk biokjemi som sjef. Etter hvert ble screeningene utvidet til å omfatte hele Norden (13).
Fra 1. januar 2017 blir NKK og Noklus slått sammen til én organisasjon.
Fra siste halvdel av 1970-årene overtok Norsk Klinisk-kjemisk Kvalitetskontroll (NKK) (stiftet i 1976) de regelmessige screeningene, og fra 1981 ble også medisinsk biokjemiske laboratorier uten akademisk leder inkludert. Formålet til NKK er å fremme kvaliteten av det arbeidet som utføres ved norske medisinsk biokjemiske laboratorier. Dette skal blant annet gjøres ved å tilby laboratoriene et bredt utvalg av eksterne kvalitetssikringsprogram. Det ble tidlig inngått et tett samarbeid med Labquality (den finske EKV-organisasjonen) med gode muligheter for NKK til å påvirke de eksterne kvalitetsvurderingsprogrammene. I dag formidler NKK program fra flere nordiske og europeiske EKV-organisasjoner. I 1992 ble Noklus etablert med Sverre Sandberg som leder. De senere år har NKK hatt et nært samarbeid med Noklus, og fra 1. januar 2017 blir de to organisasjonene slått sammen til én organisasjon med det nye navnet «Norsk kvalitetsforbedring av laboratorieundersøkelser» (Noklus). «Nye» Noklus vil tilby kvalitetsforbedring av medisinsk laboratorievirksomhet til hele den norske helsetjenesten, alt fra hjemmetjenesten til spesialisthelsetjenesten. Sammenslåingen vil gjøre det lettere å samordne tjenestene som ytes, og gi et helhetlig, koordinert tilbud.
Utvikling av analysekvaliteten - situasjonen i dag
Figur 1 viser en sammenstilling av resultatene over totalvariasjonen for seks sentrale, tilfeldig valgte analyser i medisinsk biokjemi for perioden 01.01.94 til 31.12.2015 (kolesterol, glukose, kreatinin, Ca, Mg, protein). Fra og med 1996 representerer figuren resultater fra nordiske land (Finland, Danmark og Norge), fra og med 2010 nesten bare Norge og Danmark. Figuren viser en trend som tyder på at presisjonen er blitt bedre.
ARTIKKELEN FORTSETTER UNDER FIGUREN
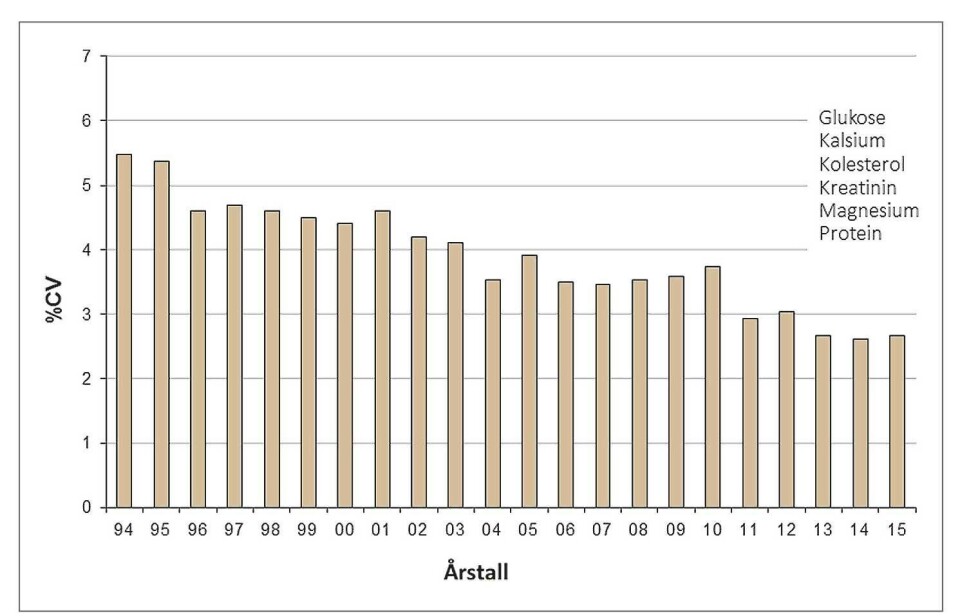
Nytt hovedprogram for medisinsk biokjemi
I 2005 startet Labquality, etter initiativ fra NKK, et alternativt program for medisinsk biokjemi. I det nye programmet «2050, 2-nivå medisinsk biokjemi», ville man prøve å nærme seg den ideelle kombinasjon av gode materialer (flytende humanbaserte sera, to i hver utsendelse) og pålitelige tillagte verdier. Dette siste skulle oppnås ved å benytte overførte verdier fra referansematerialet «NFKK Reference Serum X». De komponentene som ikke fikk tillagte verdier som var sporbare til dette materialet, fikk som tidligere verdier basert på metodekonsensus (gjennomsnitt i metodegruppen etter eksklusjon av slengere). Programmet fikk bra tilslutning i Norge fra første stund med 41 deltagere i 2005, 96 i 2009 og cirka 85 fra 2010. Programmet har mange av de samme komponentene som var med i studien fra 1966, og det er interessant å sammenligne CV oppnådd i 1966 og 2016 for samme komponenter, se tabell 1. Resultatene i 2016 omfatter stort sett norske og danske laboratorier.
TABELL 1. Totalvariasjon (CV) %
| 1966 | 2016* | |
| Protein | 6,5 | 2,5 |
| Urea | 21,0 | 4,2 |
| Kalium | 7,3 | 2,0 |
| Fosfor | 18,6 | 5,2 |
| Natrium | 3,9 | 1,6 |
| Jern | 9,6 | 4,2 |
| Kreatinin | 18,9 | 5,3 |
| Kalsium | 10,9 | 2,4 |
| Kolesterol | 17,2 | 3,2 |
(*Program 2050, oktober, Labquality)
Totalvariasjonen (CV) var mye større i 1966 sammenlignet med 2016. Dette gjelder alle komponentene, men spesielt urea, fosfat, kreatinin og kolesterol. Resultatene er ikke helt sammenlignbare da kontrollmaterialet var ulikt. I tillegg var resultatene i 2016 delt inn i metodegrupper og gjennomsnittlig CV ble beregnet med en annen beregningsmetode (14). Likevel tyder resultatene på at metodene/instrumentene måler atskillig mer presist i dag enn for 50 år siden.
EQAnord
NKK har etterhvert lagt stadig større vekt på å betone riktighet fremfor presisjon (15, 16), ettersom presisjon blir godt ivaretatt av laboratorienes interne analytiske kvalitetskontroller. Fasitsetting med referansemetoder, felles brukskalibratorer og bruk av mest mulig native prøvematerialer, har vært sentralt i den forbindelse. Samarbeidet med de nordiske søsterorganisasjonene organisert i EQAnord, har vært viktig både i denne sammenhengen og for kvalitetsutviklingsarbeidet generelt. EQAnord er et samarbeidsforum for de nordiske kvalitetssikringsorganisasjonene; NKK og Noklus (Norge), Labquality (Finland), EQUALIS (Sverige), DEKS (Danmark) og Islands Selskap for klinisk kjemi. Større satsninger har vært gjennomført som egne prosjekter, blant annet det store NORIP-prosjektet for felles nordiske referanseintervaller (17, 18). I NORIP-prosjektet var referansematerialet NFKK Reference Serum X, en ferskfrosset nativ serumpool, med som en av kontrollene. Nivået til NORIPs referanseintervaller er direkte sporbare til dette materialets sertifiserte verdier. Mange norske laboratorier bruker dette materialet for å vurdere riktigheten av sine analyser i dag (19).
Fortsatt utfordringer
Utviklingen innen laboratoriemedisin har vært enorm i løpet av de siste 50 årene. Antall metoder og instrumenter som kan analysere den samme komponenten øker, og instrumentene blir mer sensitive og spesifikke. Dette bidrar til at samme komponent analysert i samme pasientprøve, men med ulike instrument/metoder, ofte gir forskjellig svar. Samtidig øker antall komponenter og rekvirerte laboratorieprøver. Diagnostikk blir i stadig større grad basert på analyse av laboratorieprøver. Analysekvaliteten på medisinsk biokjemiske analyser er bedre i dag enn for 50 år siden, men det er fremdeles utfordringer. Den største utfordringen innen analysekvalitet i dag er riktighet, og det jobbes mye internasjonalt for å bedre standardisering/harmonisering av ulike analysemetoder (20).
Kampen mellom syrer og baser i menneskeorganismen (1966)
Lipoproteinenes fysiologi og patofysiologi (1966)

























