Fag i praksis

Overføring av smittsomme sykdommer med velferdsteknologi på sykehjem
Velferdsteknologiske hjelpemidler som interaktive pelskledde roboter og hygienestoler, brukes av beboere på sykehjem. Det er viktig med effektive og enkle metoder for å avdekke om den hygieniske standarden er god nok.
Av BJARNE HJELTNES, Universitetslektor ved OsloMet
E-post: bjarne@oslomet.no
Overføring av smittsomme sykdommer med velferdsteknologi på sykehjem.pdf(157 KB)
Velferdsteknologiske hjelpemidler som interaktive pelskledde roboter og hygienestoler, brukes av beboere på sykehjem. Det er viktig med effektive og enkle metoder for å avdekke om den hygieniske standarden er god nok.
Den ser ut som et vanlig litt stort og mykt kosedyr, men er noe langt mer. Den japanske interaktive roboten PARO (se bildet over) har form av en søt liten selunge, men den har avanserte sensorer under pelsen som gjør at den kan respondere og «kommunisere» med brukeren. Den snur seg mot deg når du snakker til den og lager koselyder når du klapper den. Er du slem mot den, sier den også ifra. Roboten brukes på norske sykehjem og har vist seg å være med å høyne livskvaliteten, særlig til demente beboere (1).
Men kan det også være farer forbundet med bruk av denne uskyldige, søte pelsdotten? Den er i nær fysisk kontakt med mange pasienter og er derfor en potensiell smittekilde. Effektiv rengjøring er vanskelig. Skal dette gjøres, må i tilfelle den kunstige pelsen skiftes ut av leverandøren, så i praksis er det kun mulig med forsiktig avtørking. Spørsmålet en da må reise, er om bruk av PARO representerer en økt fare for spredning av smittsomme sykdommer?
I 2017 gjorde undertegnede sammen med flere andre forskere en studie ved to sykehjem hvor vi samlet mikrobiologiske prøver fra pelsen til fire interaktive roboter over en periode på to måneder. Disse ble undersøkt for tilstedeværelse av klinisk relevante mikroorganismer. (2).
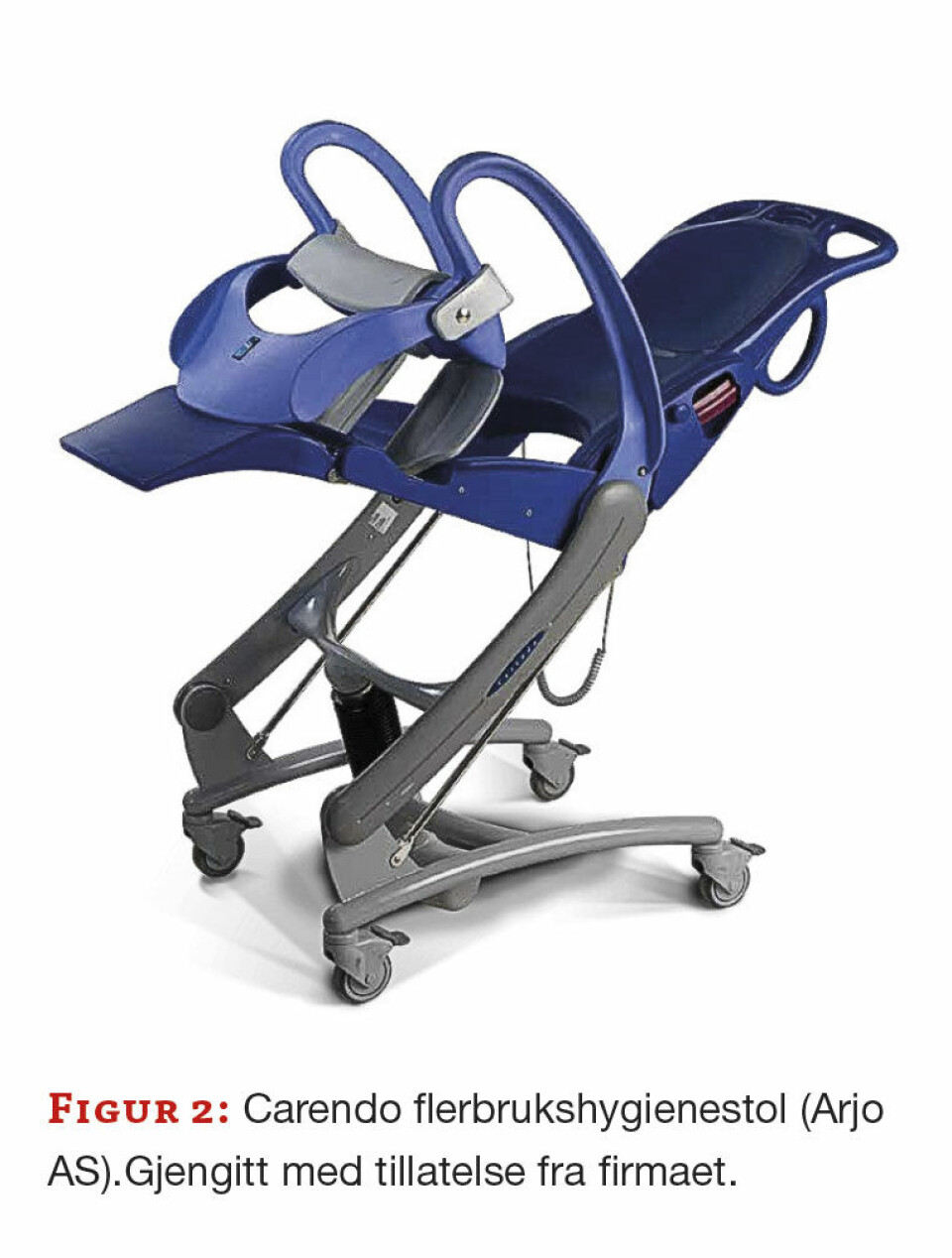
I tillegg ble det undersøkt om hygienestoler (figur 2), som brukes når pasienter skal vaskes, dusjes og stelles, var kontaminert med potensielt patogene mikroorganismer. Disse stolene har glatte og solide overflater og prøver til den mikrobiologiske undersøkelsen ble tatt etter at standard rengjøring var gjennomført. Det skal ikke være så problematisk å holde disse rene, men det er et spørsmål om sykehjemmene har gode nok rutiner, om de ansatte har fått god opplæring og har nok tid til å gjennomføre tilstrekkelig rengjøring.
Mikrobiologiske agens som ble undersøkt
Virus: Vi undersøkte om prøvene inneholdt influensavirus og norovirus, som er årsak til den vanligste typen omgangssyke/diaré. Det var ingen kjente kliniske tilfeller av hverken omgangssyke eller influensa på sykehjemmene da prøvene ble tatt. Prøvene ble dessuten tatt fem uker før influensatoppen i uke 10 dette året (3). Slik sett kunne vi ikke vente positive funn av disse virusene, noe vi heller ikke fant.
Normalflorabakterier med potensial til å gi sykdom: Vi fant ingen methicillinresistente gule stafylokokker (MRSA), men det var heller ingen kjent MRSA-smitte på noen av sykehjemmene da prøvene ble tatt. Heller ikke fant vi ESBL-produserende bakterier (Extended spectrum betalactamase) eller sporer fra Clostridioides difficile. Toksinproduserende stammer fra denne bakterien kan gi alvorlig diaré.
Vi undersøkte også om prøvene tatt fra PARO og hygienestolene inneholdt andre, mer vanlig forekommende bakterier som kan indikere økt smittefare. Her gjorde vi positive funn; hygienestolene var kontaminert med tarmbakterier. Ut fra bruksområdet til disse stolene var kanskje ikke det så uventet. Et noe mer ubehagelig funn var at også de pelskledde selrobotene var kontaminert med tarmbakterier. Vi fant også den potensielt patogene hudbakterien gule stafylokokker, både på PARO og hygienestolene. I seg selv er ikke dette urovekkende, men vi vet at den kan gi alvorlige infeksjoner hos utsatte pasienter. Funn av gule stafylokokker indikerer også at den antibiotikaresistente utgaven av denne bakterien, MRSA, vil kunne overføres med interaktive roboter. Det vil være langt mer alvorlig.
Tester som viser kontaminasjonsgrad: Både selrobotene og hygienestolene ble i tillegg til de spesifikke mikrobiologiske undersøkelsene testet med Hygiena, UltraSnap™ surface test. Dette er et enkelt og raskt testsystem som måler nivået av adenosin trifosfat (ATP) på overflaten som undersøkes. ATP er nødvendig for energiomsetningen i alle levende celler, og ATP-nivået på en overflate er en god indikator på hvor kontaminert den er med biologisk materiale (4). Målingene viste høye nivåer av kontaminasjon, spesielt på et av sykehjemmene.
Smitterisiko ved bruk av selroboter og hygienestoler
Selv om vi ikke fant alvorlige sykdomsframkallende bakterier, viser undersøkelsen at det er en smitterisiko. Det kan se ut til at bruk av søte pelskledde interaktive roboter også kan være en sykdomsrisiko for pasienter som har glede av å sitte med disse på fanget. Risikoen bør kartlegges nøyere, hygienekontroller bør gjøres og det bør utvikles og implementeres bedre rengjøringsprosedyrer.
Hygienestolene hadde glatte overflater og det skulle være enkelt, om enn noe arbeidskrevende, å rengjøre og desinfisere disse. Her burde det være enklere å få til en forbedring av den hygieniske standarden, med gjennomgang av rutinene, god opplæring samt systematiske kontroller av rengjøringen, for eksempel med ATP-målinger.
Metodiske variasjoner
Påvisning av bakterier i hygieneprøver: Påvisning av bakterier i hygieneprøver kan gjøres på flere måter. Den enkleste måten er å bruke kontaktagar. Dette er en liten petriskål som er fylt helt opp med dyrkningsagar, slik at den kan trykkes mot overflaten man vil undersøke. En annen måte er å ta prøven med pensel og så bruke penselen til å applisere prøven på agar, enten direkte eller ved oppformering i en flytende anrikningsbuljong, før det gjøres reutsæd fra denne på agar. En tredje måte er å løse opp prøvemateriale fra prøvetakingspensel i et flytende medium og så påvise eventuelle spesifikke bakterier med PCR. Ulike metoder er benyttet i ulike studier, og direkte sammenlikning kan derfor være vanskelig.
Påvisning av Clostridioides difficile: En ekstra utfordring ved påvisning av C. difficile er at dette er en sporedannende anaerob bakterie. Dyrkningsmediene som brukes, må ved siden å være tilsatt antibiotika som hindrer vekst av de fleste andre bakterier, også være tilsatt et middel som fremmer sporenes evne til å utvikle seg til vegetative bakterier som kan formere seg på vekstmedier under anaerobe forhold. Sporene i seg selv er meget bestandige. I våre undersøkelser brukte vi Braziers C. difficile selective agar, som har vist seg å være godt egnet (5).
I tillegg prøvde vi å påvise bakterien med PCR. En utfordring er her å få ekstrahert DNA fra sporene. Vi valgte å legge inn en mekanisk knusning av sporene ved risting med kuler. Tidligere undersøkelse har vist at det er mulig å påvise C. difficile fra miljløprøver med PCR-metodikk (6).
En enkel og forholdsvis hurtig metode for å påvise C. difficile hadde vært å bruke kontaktagar, men denne var ikke tilgjengelig da undersøkelsen ble gjort. Senere undersøkelser som vi har gjort, har vist at den enkle kontaktagarmetoden også er den mest sensitive (se egen artikkel).
Påvisning av MRSA: Påvisning av denne bakterien er ikke fullt så utfordrende som påvisning av C. difficile. Prøvene ble tatt med pensel på et definert område av objektet. Det ble gjort direkte utsæd på et selektivt kromogent medium for påvisning av MRSA; Oxoid Brilliance MRSA-2. Alternativt ble prøvene sådd ut i et selektivt anrikningsmedium for MRSA; PHMB anrikningsmedium, som har vist seg å være velegnet til å isolere og oppformere MRSA i biologiske prøver som inneholder små mengder MRSA i en blandet flora av andre bakterier (7,8). Fra medier med vekst ble det gjort utsæd til Oxoid Brilliance MRSA-2, og i tillegg ble det gjort PCR for å påvise resistensgener forenelig med MRSA.
Da denne undersøkelsen ble gjort hadde vi ikke kontaktagarmetoden tilgjengelig. Vi har i ettertid gjort forsøk som viser at kontaktagar er den beste og mest sensitive metoden (se egen artikkel). Metoden er dessuten en enkel, billig og lite arbeidskrevende; «Det enkle er ofte det beste».
Overlevelse av virus med tanke på dagens koronaepidemi
Ulike metoder har hver sine styrker og svakheter. Selv om PCR er kjent som en sensitiv metode kan den kun påvise tilstedeværelse av virus eller bakterier og ikke om viruset/ bakteriene er levende og kan smitte. For å få sikker kunnskap om hvor lenge virus/bakterier overlever på ulike overflater, må man benytte dyrkningsbaserte metoder.
For tretti år siden var utsæd i cellekultur den vanligste måten å påvise levende virus. Da ble det brukt celler som man hadde sett var mottakelig for infeksjon av de virusene man ønsket å påvise. Cellekulturen ble så undersøkt gjennom flere dager med henblikk på cytopatogen effekt (CPE). Dette var en arbeidskrevende, langsom og dyr metode, så det var naturlig at alle rutinelaboratoriene gikk over til PCR da det ble tilgjengelig. Det har resultert i at den gamle dyrkningsmetoden nå stort sett er begrenset til noen få forskningslaboratorier.
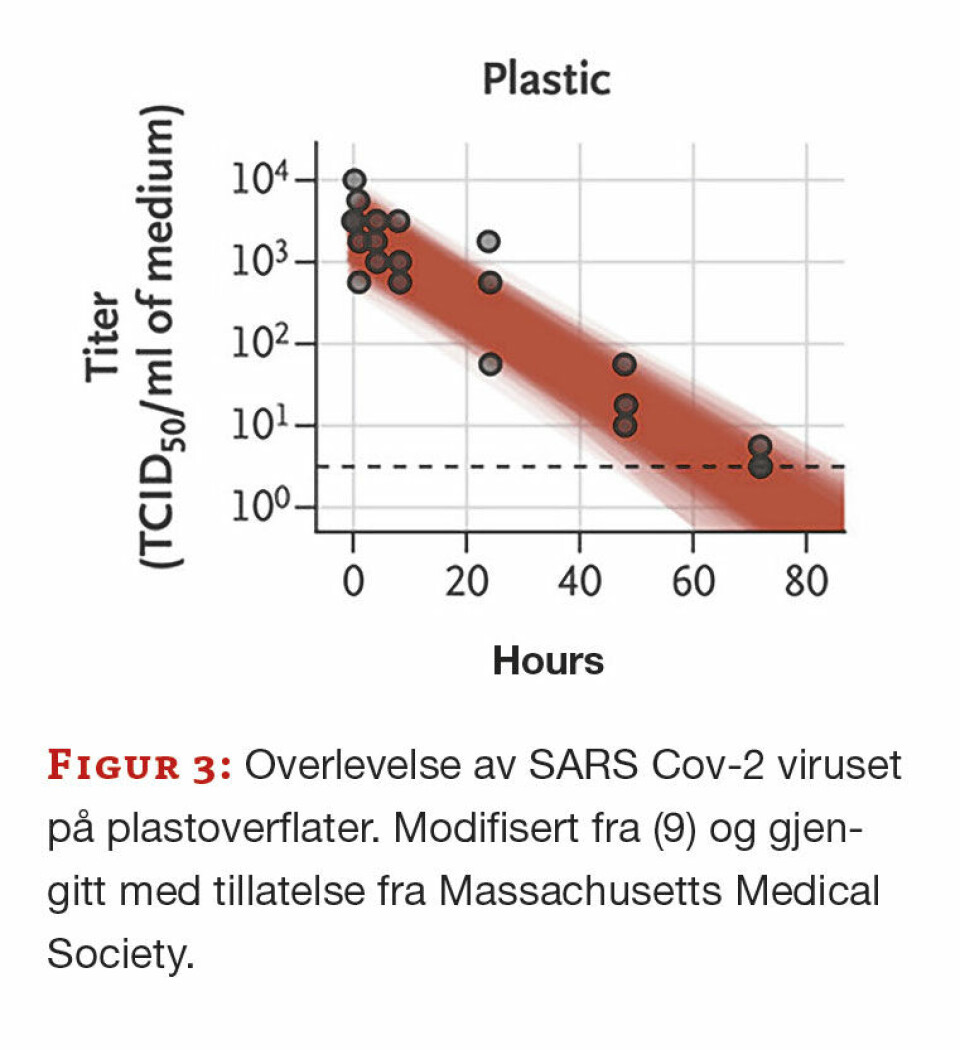
For å kunne undersøke hvor lenge virus kan overleve i forskjellige miljøer/overflater er ikke PCR noen aktuell metode. Her må den tradisjonelle metoden med dyrkning i cellekultur brukes. Dette er blitt aktualisert nå under koronapandemien hvor kunnskap om dette virusets evne til å overleve i ulike miljøer er viktig for å iverksette målrettede smitteverntiltak. En forskningsgruppe under ledelse av N. van Doremale har kartlagt SARS Cov-2 stabilitet i aerosoler og på ulike materialer (9). Dette har de gjort ved gjentatte forsøk med å spre realistiske konsentrasjoner av viruset på de objektene de ønsket å undersøke. Prøver tatt ved ulike tidspunkt ble sådd ut i cellekulturer som så ble undersøkt for CPE. På denne måten har man kartlagt hvor lang tid det tar før konsentrasjonen av levende virus er kommet under TCID50, som er den konsentrasjonen av virus som er nødvendig for å gi CPE i 50% eller mer av cellene i en kultur.
Målingene viste at virus kan holde seg smittefarlig i luft (aerosoler) i inntil tre timer, på papp/papir i ett døgn og på glatte overflater i tre døgn (figur 3). Det er usikkerhet knyttet til disse undersøkelsene. Måling av overlevelse på overflater er gjort ved temperatur på 21-23 grader og relativ fuktighet på 40%, mens måling av overlevelse i aerosoler er gjort i 65% relativ fuktighet. De forteller oss likevel noe om hvordan vi må beskytte oss for ikke å bli smittet: Viruset kan smitte gjennom indirekte kontakt og gjennom luft ved aerosoler.
Alvorligheten i dagens pandemisituasjon aktualiserer hvor viktig det er å ha gode metoder for å kartlegge smittereservoarer av patogene mikrober enten det er sykdomsframkallende og antibiotikaresistente bakterier - eller virus.
























