Fag i praksis
Effektiv og rimelig påvisning av MRSA og Clostridioides difficile-sporer fra hygienestoler ved hjelp av kontaktagar
Kontaktagarmetoden har god sensitivitet og er enkel å utføre. Det kan føre til at det blir tatt flere prøver, noe som vil styrke smittevernet.
Av BJARNE HJELTNES, bioingeniør, MSc(1); COLIN CHARNOCK, PhD(1); ANDRÉ INGEBRETSEN, MSc(2,4); JÖRN KLEIN J, PhD(3); HEGE S. TUNSJØ, bioingeniør, PhD(1).
- Institutt for naturvitenskapelige helsefag, OsloMet – storbyuniversitetet.
- Avdeling for Mikrobiologi, Oslo universitetssykehus.
- Institutt for sykepleie- og helsevitenskap, Universitetet i Søraust-Noreg.
- Avdeling for smittevern, Oslo universitetssykehus.
E-post: Hege Tunsjø; hetu@oslomet.no
Sykehjemsbeboere er særlig mottagelige for infeksjoner på grunn av høy alder, hyppige sykehusopphold og gjentagende antibiotikabehandlinger. Forekomst av resistente mikrober i sykehjem er ikke uvanlig, og overføring av resistente mikrober mellom beboere og helsepersonell kan foregå på mange ulike måter. Kommuner tar i stadig større grad i bruk velferdsteknologi både i hjemmetjenestene og på sykehjem. Dette kan være mobile trygghetsalarmer, automatiske medisindispensere, avanserte stellestoler/hygienestoler og robotteknologi (1). Noen av produktene kommer i tett kontakt med flere pasienter og kan utgjøre en kilde for smitte. Risikoen for overføring av mikrober og resistensgener gjennom slike produkter er lite kjent.
Hvilke metoder som egner seg best til å ta prøver fra de velferdsteknologiske hjelpemidlene er i liten grad undersøkt, og litteraturen er ikke entydig. For å etablere en god nok overvåkning av overflatekontaminasjon, er det viktig med rutiner som gir pålitelige svar og som er enkle å gjennomføre. Denne studien har undersøkt ulike prøvetakingsmetoder fra polyvinylmembraner (PVC), som ofte utgjør overflaten på hygienestoler, og flere påvisingsmetoder for to utvalgte bakterier som er assosiert med utbrudd i sykehjem; Clostridioides difficile og methicillinresistente Staphylococcus aureus (MRSA). Analytisk sensitivitet, tidsbruk, pris og ressursbruk er faktorer som ble vurdert i studien. I tillegg ble det gjort en overvåking av hvor lenge mikrobene kunne detekteres på PVC-overflatene.
Metode
C. difficile (CCUG 54206) ble dyrket på Braziers C. difficile selective agar (Oxoid Ltd, Hampshire, England) i 10 dager for å fremme sporulering. En oppslemming av bakteriene i 0,9% NaCl ble så varmet opp til 70⁰C i 20 minutter for å lysere levende celler slik at kun sporer var igjen i løsningen. En 10-folds fortynningsrekke ble laget og 100 µl (i seks replikater) av hver av åtte fortynninger ble spredt utover på hvert sitt stykke (5 x 5 cm) av PVC-membran fra Carino/Carendo Hygienestoler tilsendt fra produsent (ArjoHuntleigh, Stockholm, Sverige). En fortynningsserie ble også laget av MRSA (CCUG 25922) og applisert på PVC-membraner som beskrevet. Det ble benyttet ulike protokoller for prøvetaking fra PVC-menbranene og ulike metoder for påvisning av de to ulike mikrobene (figur 1). For å undersøke hvor lenge mikrobene kunne detekteres på tørre overflater ble ulike inokulum sådd ut på PVC-membraner som ble oppbevart ved romtemperatur før de ble undersøkt med kontaktagarmetoden etter 7, 14, 21 og 28 dager. Alle forsøkene ble utført ved to tidspunkter.
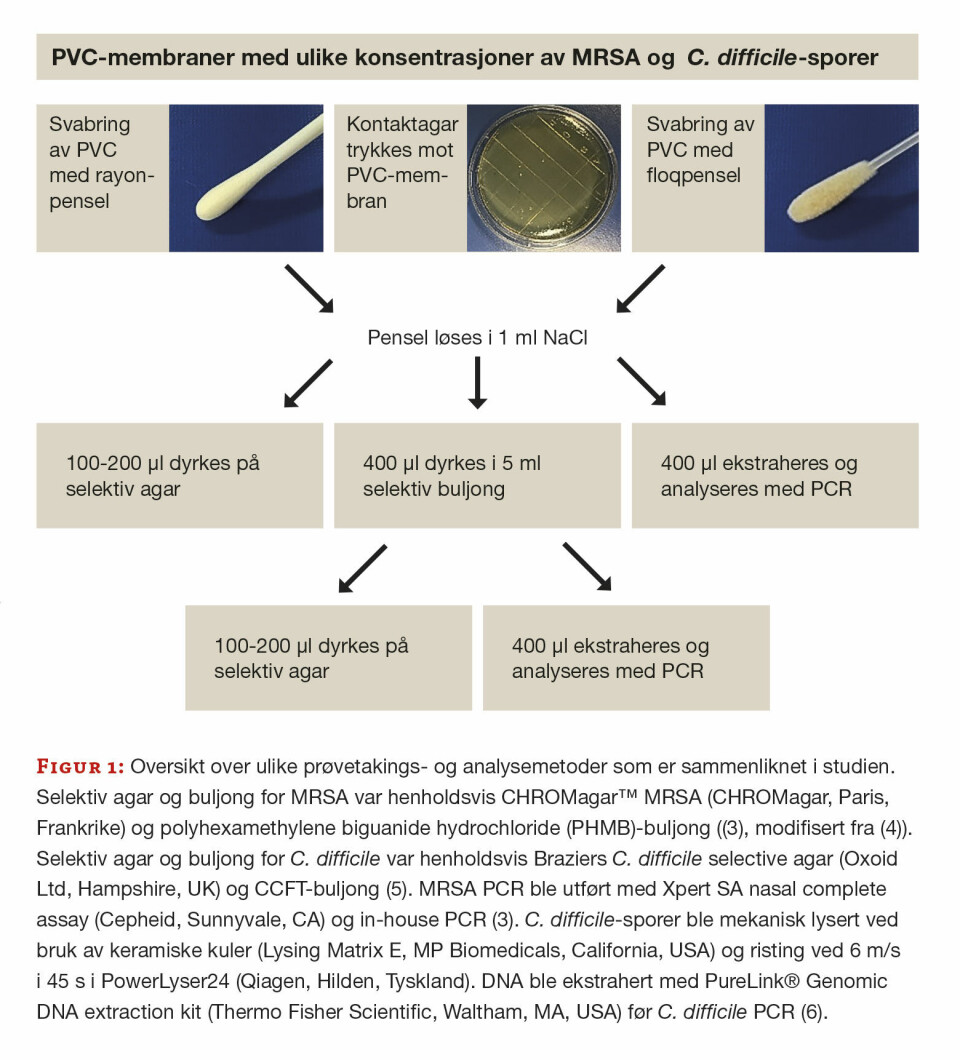
Resultater og diskusjon
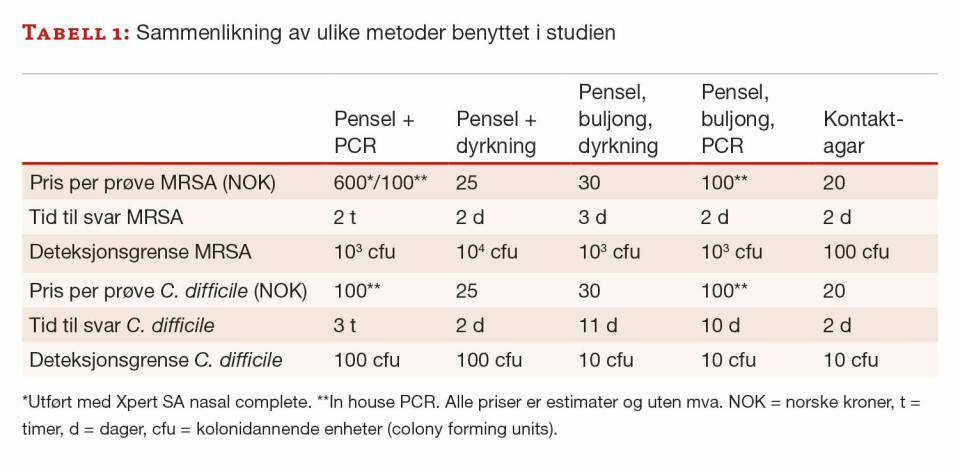
I denne studien hadde kontaktagarmetoden bedre eller tilsvarende sensitivitet som alle de andre metodene som ble undersøkt, også de molekylære metodene (tabell 1). Tid til svar med kontaktagar var to dager og dermed lenger enn ved direkte PCR-analyse. Ved miljøovervåkning er tid til svar imidlertid ikke like kritisk som i en diagnostisk situasjon. Svabring med pensel etterfulgt av dyrkning på selektiv agar var den minst sensitive metoden. Selv om det ble sådd ut en mindre mengde på agar enn ved de andre metodene, kan ikke forskjellene kun forklares med dette. Det var ingen forskjell mellom bruk av rayon- eller floqpensel, to materialer som har vist seg å ha ulik sensitivitet ved prøvetaking fra luftveier (2). Da materialet fra penselen ble oppformert i selektiv buljong, etterfulgt av dyrkning på agar eller PCR, økte sensitiviteten. For C. difficile ble sensitiviteten tilsvarende god som ved kontaktagarmetoden, men tid og ressurser benyttet var betydelig høyere (tabell 1). Våre resultater er i tråd med flere andre studier der ulike typer kontakagarer kom best ut (7,8).
Etter fire uker var det fortsatt mulig å påvise både C. difficile og MRSA fra PVC-overflater med kontaktagarmetoden. MRSA krevde imidlertid svært stort inokulum for å overleve på PVC-overflatene (105–106 cfu/ml). Clostridioides difficile-sporer var mulig å påvise i fire uker fra et betydelig lavere inokulum (103 cfu/ml). Resultatene kan skyldes at levende stafylokokkceller er mer følsomme for ytre faktorer enn C. difficile-sporer, som blant annet uttørking og mulig antibakteriell aktivitet fra PVC-membranen.
Undersøkelse av et stort nok antall prøver og overflater er avgjørende for god miljøovervåkning. Hygienestoler og glatte overflater ser ut til å være spesielt godt egnet for å bruke kontaktagar. I tillegg til fortrinn i sensitivitet, er prisen for kontaktagarmetoden signifikant lavere enn for molekylære metoder. Undersøkelse med kontaktagar kan også utføres av personalet som jobber i sykehjemmene. God sensitivitet kombinert med effektive metoder og lave priser vil trolig føre til at det tas flere prøver og det vil totalt sett gi et bedre smittevern.
Takk
Takk til ArjoHuntleigh, for bidrag med PVC-membraner og Norsk Overvåkning av Resistente Mikroorganismer (NORM) for finansiering av studien.
Referanser
- Nakrem S og Jóhannes S. Velferdsteknologi i praksis: perspektiver på teknologi i kommunal helse- og omsorgstjeneste. Oslo: Cappelen Damm akademisk; 2017.
- Warisa M, Osterbacka R, Lahtib E, Vuorinena T, Ruuskanenb, O, Peltolab V. Comparison of sampling methods for the detection of human rhinovirus RNA. J Clin Virol. 2013;58:200–4.
- Tunsjø HS, Follin-Arbelet B, Clausen NM, Ness Y, Leegaard TM, Bemanian V. A rapid, high-throughput screening method for carriage of methicillin-resistant Staphylococcus aureus. APMIS. 2013;21(9):865-70.
- Wertheim H, Verbrugh HA, van Pelt C, de Man P, van Belkum A, Vos MC. Improved detection of methicillin-resistant Staphylococcus aureus using phenyl mannitol broth containing aztreonam and ceftizoxime. J Clin Microbiol. 2001;39(7):2660-2.
- George WL, Sutter VL, Citron D, Finegold SM. Selective and differential medium for isolation of Clostridium difficile. J Clin Microbiol. 1979;9(2):214-9.
- Mutters R, Nonnenmacher C, Susin C, Albrecht U, Kropatsch R, Schumacher S. Quantitative detection of Clostridium difficile in hospital environmental samples by real-time polymerase chain reaction. J Hosp Infect. 2009;71(1):43-8.
- Buggy BP, Wilson KH, Fekety R. Comparison of Methods for Recovery of Clostridium difficile from an Environmental Surface. J Clin Microbiol. 1983;18(2):348-52.
- Claro T, Daniels S, Humphreys H. Detecting Clostridium difficile Spores from Inanimate Surfaces of the Hospital Environment: Which Method Is Best? J Clin Microbiol. 2014;52(9):3426–8.
























