FAG Aktuelt

Pasient møter bioingeniør: «Jeg har aldri tenkt over at det budskapet legene gir meg, kommer fra noen andre»
Det er noen tiår siden nå, men Stein-Magne Aksnes husker godt alle besøkene på Haukeland universitetssjukehus; på barneavdelingen og på poliklinikken. Ni år med leukemi setter spor.
Av GRETE HANSEN, journalist
Stein-Magne Aksnes (43) er på gamle tomter. Helt til han var 20 år, var han til jevnlige kontroller på Barneklinikken ved Haukeland universitetssjukehus. Han var fem da han fikk diagnosen akutt lymfatisk leukemi (ALL), åtte da han fikk første tilbakefall og 13 da han fikk det andre. Men selv om han har gått inn og ut av dørene på Haukeland, har han aldri vært der vi befinner oss nå – på et laboratorium. Vi er på Seksjon for kreftgenomikk (SKG), en forholdsvis ny seksjon ved Laboratorieklinikken, som både huser en enhet for blodgenomikk (der vi er) og en for tumorgenomikk.
Hilde Mæland tar smilende imot oss. Hun er fagbioingeniør med ansvar for leukemidiagnostikk. Det er ikke ofte hun har pasienter på besøk, men pasientprøver har hun mange av - hun har diagnostisert leukemier i en årrekke.

- En stor del av jobben min er å utelukke eller bekrefte leukemier. Det kommer bare to – tre beinmargsprøver i uka der det er mistanke om akutt leukemi, men når de ankommer, legger vi til gjengjeld fra oss alt annet.
Benmargstransplantasjon
Det er Bioingeniøren som har invitert Aksnes med på labbesøk. Sammen skal vi lytte og lære og forhåpentligvis vet vi mer om moderne leukemidiagnostikk når vi forlater laben.
Mæland er ikke sikker på hvilke analyser som var mest aktuelle på 80-tallet da Aksnes fikk leukemidiagnosen for første gang, men at det har skjedd mye og at mange flere overlever ALL i dag, det vet hun.
Aksnes overlevde, men det var ingen selvfølge. Store deler av barndommen hans var preget av kreftsykdommen. Da han var 13 og fikk sitt andre tilbakefall, var det ingen vei utenom en beinmargstransplantasjon, med søsteren som donor. Det var en helt ny behandling den gang, Aksnes var den fjerde i landet med ALL som fikk tilbudet på Rikshospitalet i Oslo. Det ble en dramatisk tid for tenåringen. Etter transplantasjonen ble det bestemt at han skulle få intensiv strålebehandling. Etter fire runder med det, kollapset lungene.

Frisk som 14-åring
- Det var tøft for hele familien. Moren min døde av kreft rett før jeg fikk det andre tilbakefallet – og kort tid etter svevde jeg mellom liv og død etter at lungene kollapset, sier Aksnes.
Men det gikk altså bra, så bra som tida og forholdene tillot; han ble erklært frisk som 14-åring. Men senvirkningene var mange …
- I dag ville du forhåpentligvis sluppet billigere fra det. Behandlingen ville vært mye mer tilpasset akkurat din leukemi.
Og hadde det likevel vært aktuelt med beinmargstransplantasjon, ville dagens analyser avslørt det på et tidligere tidspunkt. Du hadde kanskje fått transplantasjon som liten gutt og sluppet tilbakefall, forklarer Mæland.
Hun tar oss med rundt i seksjonens mange små og store rom og viser fram apparatur og skjermbilder. Det første hun gjør når det kommer inn beinmarg fra en pasient med mistanke om leukemi, er å dyrke den.
- Dette er spennende!
Mæland plasserer seg ved en skjerm som viser kreftceller fra beinmarg. De er dyrket over natta, før de ble farget med Giemsa (såkalt G-banding).
- Vi ønsker å fange cellene i det stadiet i cellesyklus som kalles metafase, da kan vi se kromosomene. Hos en del finner vi ikke feil med de metodene som vi benytter i dag, selv om de har ALL, men hvis vi finner kromosomfeil, ser vi at kreftcellene ofte har brudd i gener som er «hot spot» for denne typen leukemi. Det er ubehagelig å finne brudd i MLL-genet, for det gir dårlig prognose, forklarer hun.
Aksnes følger oppmerksomt med. Han vet ikke hvilke gener som var endret i kreftcellene hans, men han skjønner at det ligger atskillig mer arbeid bak leukemidiagnosen enn han på forhånd kunne tenke seg.
- Dette er spennende! Jeg har aldri tenkt over at det budskapet legene gir meg, kommer fra noen andre. Det har rett og slett ikke slått meg.
- Nei, det er ikke legene som finner genfeilen – det er vi bioingeniører, og det er flere laboratorier involvert, sier Mæland.
Bidrag fra mange laber
For når røret med pasientens beinmarg ankommer SKG, er den sannsynligvis allerede analysert på hematologilaben ved Laboratorium for medisinsk biokjemi og farmakologi – og med «flowcytometri» på blodbanken. Det er ofte flowresultatet som avslører diagnosen, Mælands bidrag er å finne ut hvilken leukemitype det er snakk om – og hvor hissig den er. Hun undersøker hvilke genetiske avvik det er snakk om.
- Våre svar kan både bestemme og endre behandling, for eksempel til en mildere behandling som gir færre bi- og senvirkninger, sier hun.
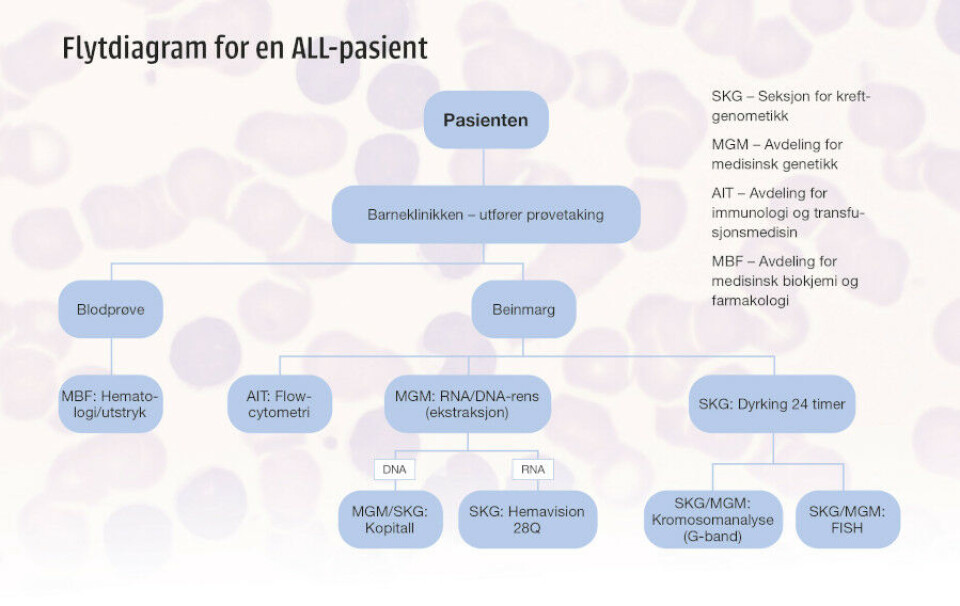
Og hun har mer å vise fram. Kromosomanalysen er bare én av flere diagnostikkmuligheter. Om ikke den ene metoden påviser kreft, kan en annen gjøre det. FISH (Fluorescens In Situ Hybridisering), for eksempel, sier Mæland og nikker mot en ny skjerm som viser knallblå celler med røde og grønne signaler - FISH-prober. En annen viser tallrike små blå brønner. Det er bilde fra translokasjonsscreeningen, som alltid gjøres på RNA ved akutte leukemier.
- Hver pasientprøve har 23 brønner. Vi sjekker hver og en av dem, ser på kurvene og eksporterer data. Via beregninger og algoritmer kan vi finne ut hvor eventuelle genfeil ligger.
Mange senvirkninger
Aksnes blir bombardert med informasjon nå. Mæland forteller om DNA- og RNA-ekstraksjon, og om mikroskopet som tar hundrevis av bilder av kreftcellene. Ved ALL kan de være av dårligere kvalitet enn ved andre typer leukemi. De er vanskeligere å analysere enn celler ved myelogene leukemier. Vi tar også en titt i fryseren der bokser fulle av små rør med cellesuspensjon og isolert RNA/DNA lagres. Den fungerer som en liten leukemibiobank.

Den tidligere leukemipasienten ser både sunn og frisk ut, og han har det bra, forsikrer han, selv om han aldri blir kvitt senvirkningene etter den tøffe kreftbehandlingen. Og om informasjonsflommen blir i meste laget, skjuler han det godt.
Han er uføretrygdet nå, forteller han. Det var først og fremst lungekapasiteten og finmotorikken som ble redusert av den beinharde behandlingen. Etter videregående forsøkte han seg på høyere utdanning, men måtte gi opp.
- Det ble for utmattende – jeg klarte ikke å følge med, forteller han.
Verken han eller Mæland vet om leukemivarianten han hadde, var spesielt hissig. For 30-40 år siden ble ikke det kartlagt på samme måte som teknologien tillater i dag. Mæland forteller at hun selv puster lettet ut hvis translokasjonsscreeningen avslører en translokasjon mellom kromosom 12 og 21 – eller en hyperdiploidi (for mange kromosomer). Da er det gode muligheter for et mildere sykdomsforløp.
Mange blodprøver i årenes løp
Om ikke Aksnes har vært på en sykehuslab før, har han truffet mange bioingeniører. Han har tatt utallige blodprøver opp gjennom årene.
- Det har gått bra. Jeg tror jeg har vært en veldig tålmodig pasient – også som barn. Jeg var aldri redd for å ta blodprøver, det var bare noe man måtte igjennom. Det jeg var redd for, var narkose. Jeg ville ikke sovne – ville ikke miste kontrollen.
Han er heller ikke redd for å få kreft igjen, han frykter demenssykdommer mer, sier han.
- Jeg spør jo meg selv hvordan kroppen min ville tålt enda en omgang med kreft, men redd er jeg ikke.
Snart i gang med NGS
Skulle han likevel oppleve akkurat det, finnes det lyspunkter. Både diagnostisering og behandling er blitt mye bedre for flere kreftsykdommer, enn de var på 80- og 90-tallet.
Seksjon for kreftgenomikk er for eksempel i gang med å utvikle bedre metoder for presisjonsmedisin. Akkurat nå setter de opp NGS (Neste Generasjons Sekvensering) og Mæland regner med at de er i gang med diagnostisering tidlig i 2022.
- Med NGS kan vi gi svar på utallig flere markører enn vi klarer i dag. En fagbioingeniør her på seksjonen prøver nå ut om NGS kan erstatte andre analyser og gi mer eksakte svar, forteller hun.
NGS kan også hjelpe kreftpasienter som det per i dag ikke finnes behandling for. I den norske «IMPRESS-studien», som startet opp i januar 2021, får pasienter som har fullført standardbehandling uten å bli frisk, prøve ut legemidler som er godkjent til bruk på andre kreftformer. Slik persontilpasset behandling vil være basert på de molekylære testene som Mælands kolleger nå prøver ut.
- Målet er flere overlevende, enda mer skreddersydd behandling og enda færre bivirkninger og senskader, sier Hilde Mæland.
------------------------------------------------------------------------------------------
Bioingeniørene deltar under beinmargspunksjon av barn
Når et barn kommer inn med mistanke om akutt lymfatisk leukemi, er bioingeniørene på Barne- og ungdomsklinikken raskt på plass.
- Det er vi som tar den første blodprøven – innkomstprøven - og den gir oss en indikasjon. Hvis hb og plater er lave og vi får opp blastmelding, skjønner vi ofte tegningen, forteller Alma Tuastad, bioingeniør med fagansvar ved laboratoriet på Barne- og ungdomsklinikken på Haukeland.
Barn (0-18 år) blir lagt i narkose ved beinmargspunksjon – og det er viktig at alt går riktig for seg sånn at det ikke blir nødvendig med nye prøver. Derfor er bioingeniørene til stede under prosedyren.
Internasjonal protokoll
- Vi følger en internasjonal behandlingsprotokoll som beskriver nøye hvordan beinmargen skal fordeles, sier Tuastad – og forteller hvordan hun og kollegene går fram:
- Det første aspiratet strykes ut der og da, for å sikre at legen har truffet riktig og at det virkelig er beinmarg som trekkes ut. Så prioriterer vi etter hvert som sprøytene fylles - så mye hit og så mye dit. Det kan bli noen sprøyter. Helst skal det være nok til forskning også.

Barne- og ungdomsklinikken får ikke inn mer enn fem - ti nye ALL-pasienter årlig, men prosedyrene med beinmargspunksjon skjer atskillig oftere, siden pasientene følges opp med nye prøver under behandlingsforløpet.
Stas å få være med
Tuastad har litt høyere puls enn vanlig når hun er med på en beinmargspunksjon, innrømmer hun, men egentlig er det ingen grunn til det.
- Selvsagt kan vi gjøre feil. Prøvematerialet kan koagulere og vi kan fordele feil, men det skjer ikke. Prosedyrene er gode, og vi vet akkurat hva vi skal gjøre. Det er stas å få være med på en så viktig del av diagnostiseringen, sier Alma Tuastad.
Takk!
Stor takk til Aud Valle Hansen for god hjelp både til planlegging og til kvalitetssikring av det faglige innholdet i denne reportasjen.
























