Fra fagmiljøene
Bak kulissene i spesialkoagulasjonslaboratoriet: Detektivarbeid for å avdekke medikament-interferens ved utredning av økt trombosetendens
Hvordan håndterer et spesialkoagulasjonslaboratorium interferens fra blodfortynnende medisiner? Bli med bak kulissene på Seksjon for hemostase og trombose ved Oslo universitetssykehus, hvor rutinekoagulasjonsanalyser avdekker preanalytiske feilkilder.
1. Avdeling for medisinsk biokjemi, Seksjon for hemostase og trombose, Oslo universitetssykehus, Rikshospitalet
Last ned pdf
Trombose, eller dannelse av blodpropp i en blodåre, kan føre til nedsatt blodstrøm til omkringliggende vev, som kan resultere i celleskade og celledød. Det finnes både arvelige og ervervede risikofaktorer for trombose. I omtrent 50 % av tilfellene finner man imidlertid ingen sikker utløsende årsak. Andre forhold som immobilisering, kirurgi, bruk av p-piller, høy alder og svangerskap øker også risikoen for trombose. Kombineres disse risikofaktorene med en arvelig eller ervervet tilstand, øker risikoen ytterligere. I Norge rammes omtrent én person i timen av blodpropp, og utgjør dermed en betydelig pasientgruppe (1).
Ved Seksjon for hemostase og trombose (SHOT) ved Oslo universitetssykehus (OUS) utfører vi omtrent 4500 utredninger for arvelige og/eller ervervede tilstander som kan gi økt risiko for trombose i året. Rask behandling er kritisk når en trombose er diagnostisert, og pågående antikoagulasjonsbehandling under prøvetaking er ofte uunngåelig. Midlertidig stans av behandling for å ta blodprøver kan øke risikoen for nye tromboser og er derfor sjeldent et alternativ. Dette betyr at et betydelig antall prøver vi mottar, er tatt mens pasienten står på antikoagulantia.
Bruk av antikoagulantia kan påvirke flere koagulasjonsanalyser og gi feil resultat som i ytterste konsekvens kan føre til feildiagnostisering og feil behandling. Majoriteten av prøvene vi analyserer er tilsendte fra primærhelsetjenesten og eksterne sykehus, og tilgangen på kliniske opplysninger er avhengig av hva som oppgis av rekvirent. Av erfaring er disse opplysningene ofte mangelfulle, og for å oppdage tilstedeværelse av antikoagulantia i prøver utfører vi målinger av rutinekoagulasjonsanalysene APTT (aktivert partiell tromboplastintid), protrombintid (PT) Quick (≈INR), fibrinogen, anti-faktor Xa-aktivitet og i noen tilfeller trombintid. I denne artikkelen vil vi gå gjennom hvordan vi bruker disse analysene til å oppdage denne preanalytiske utfordringen, samt forklare hvordan antikoagulantia påvirker våre spesialanalyser.
Laboratorieutredning av økt trombosetendens
Blodets evne til å koagulere er avgjørende for å forhindre blodtap ved skader. Denne komplekse og nøye regulerte prosessen foregår kontinuerlig i kroppen. Blodplater, karvegg, koagulasjonsfaktorer og koagulasjonshemmere spiller alle en rolle i dannelsen av blodplateplugg og fibrinnettverk der det er nødvendig, uten at det dannes unødvendige eller for store blodpropper (figur 1).
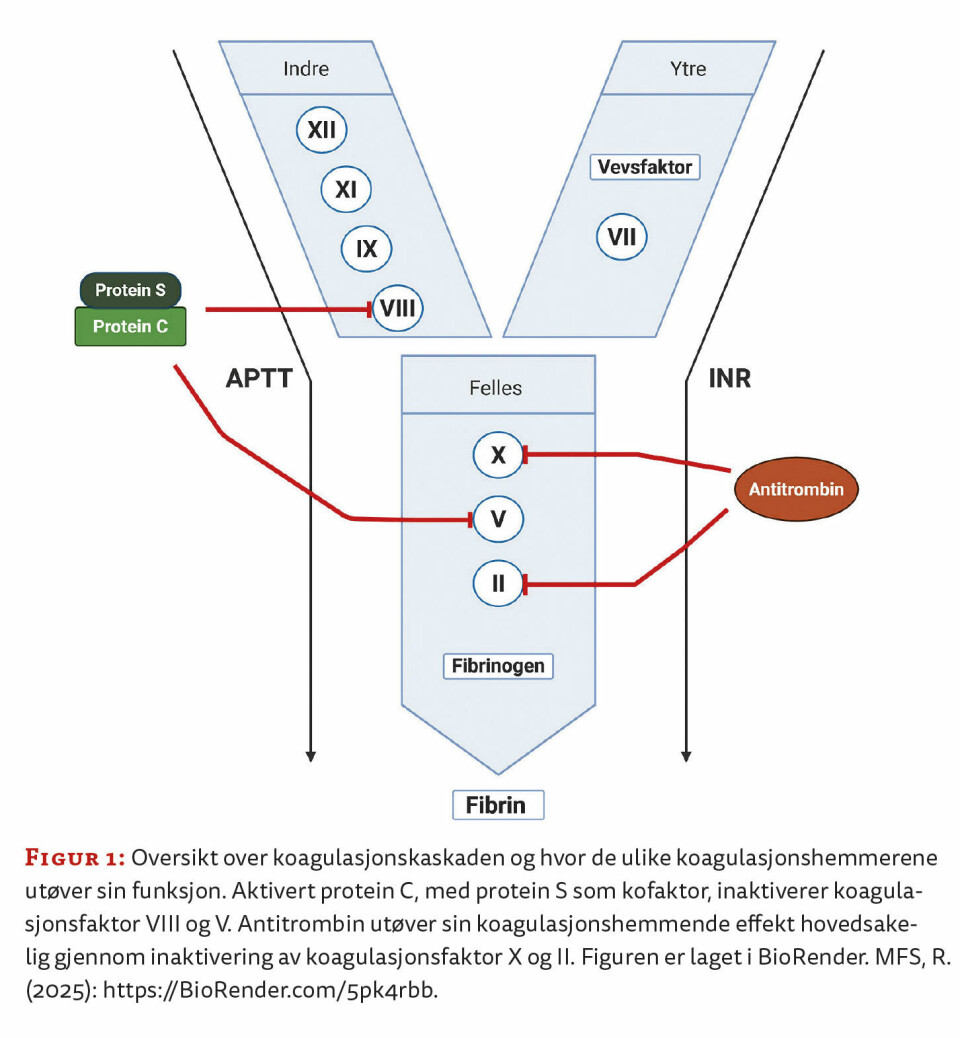
Ved laboratorieutredning av økt trombosetendens kan det utredes for både arvelige og ervervede risikofaktorer. Blant de arvelige risikofaktorene er koagulasjonshemmerne antitrombin, protein C og protein S de viktigste. Nedsatt mengde og/eller nedsatt aktivitet av disse kan øke risikoen for trombose. Protein C og protein S er vitamin K-avhengige plasmaproteiner som hovedsakelig produseres i leveren, mens antitrombin er et glykoprotein som produseres i lever og endotel.
Vi utreder også for den ervervede tilstanden antifosfolipidsyndrom, en autoimmun sykdom hvor heterogene autoantistoffer blant annet gir økt risiko for tromboser. Laboratoriekriteriene for å diagnostisere antifosfolipidsyndrom innebærer å påvise antistoffer ved å analysere lupusantikoagulant, kardiolipinantistoff og β2-glykoprotein 1-antistoff (tabell 1).

Valg av koagulasjonsanalyser til den preanalytiske vurderingen
Tidlig behandling er avgjørende for å forhindre alvorlige komplikasjoner som kan følge av blodpropp. Standardbehandling innebærer ofte bruk av antikoagulasjonsmidler. Disse medisinene reduserer blodets evne til å koagulere, hindrer vekst av eksisterende blodpropper og forhindrer dannelsen av nye.
De antikoagulasjonsmidlene som benyttes i behandling av blodpropp i dag er heparin, vitamin K-antagonist (warfarin) og direktevirkende orale koagulasjonsmidler (DOAK). Som nevnt i innledningen påvirker disse medikamentene spesialkoagulasjonsanalyser og kan gi feilaktige resultater. Internasjonale retningslinjer fra Clinical and Laboratory Standards Institute (CLSI), anbefaler derfor å analysere rutinekoagulasjonsanalysene PT, APTT og trombintid (TT) som en screening for å fange opp en eventuell tilstedeværelse av antikoagulasjonsmiddel i prøver som er til utredning for økt trombosetendens (2). På SHOT har vi fulgt disse anbefalingene siden 2013 og har opparbeidet mye erfaring.
De siste 15 årene har det skjedd en stor utvikling innen behandling av trombose. Dette har medført at vi på laboratoriet har måttet tilpasse og utvide den preanalytiske screeningen for å fange opp interferens av de nye antikoagulantiaene. I 2014 ble DOAK godkjent for bruk i Norge, og er nå de mest benyttede antikoagulasjonsmidlene. Før dette var warfarin (Marevan®) i kombinasjon med lavmolekylært heparin (LMWH) standardbehandling. Blant årsakene til at DOAK raskt erstattet warfarin er at de ikke krever rutinemessig monitorering og at effekten ikke påvirkes av kosthold. Den vanligste typen DOAK som benyttes i Norge i dag er Xa-hemmere, mens IIa-hemmere brukes i mye mindre grad (3). DOAK vil i mange tilfeller ikke forlenge APTT og PT Quick, og disse metodene er derfor ikke egnet til å oppdage tilstedeværelse av legemiddelet. I 2014 inkluderte vi derfor analysen anti-faktor Xa-aktivitetsmåling (A-FXa) i vår preanalytiske screening (4).
Rutinekoagulasjonsanalyser som verktøy for å oppdage antikoagulantia i prøver
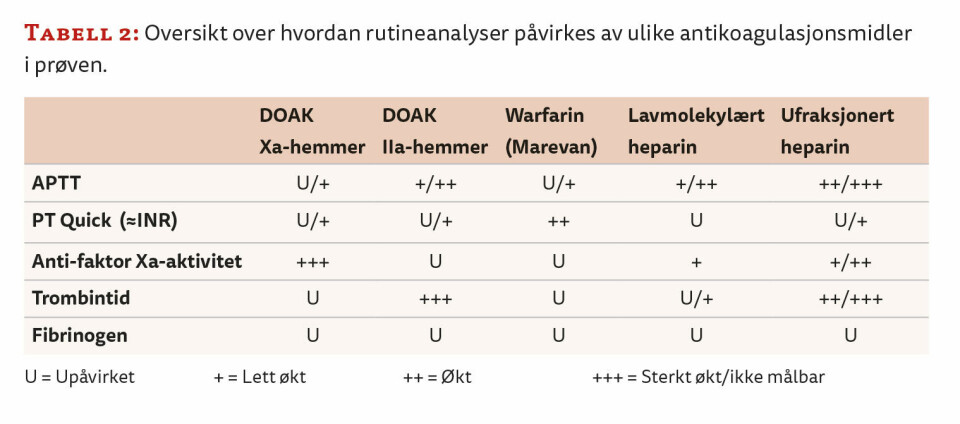
Fordi ulike antikoagulantia har spesifikke effekter på forskjellige rutinekoagulasjonsanalyser, er det mulig å identifisere de ulike medikamentene ved å utføre disse analysene. En oversikt over hvordan rutineanalyser påvirkes av ulike antikoagulasjonsmidler i prøven er gitt i tabell 2.
DOAK
For å oppdage tilstedeværelse av direktevirkende Xa-hemmere som rivaroksaban, apiksaban og edoksaban i prøven, utføres anti-faktor Xa-aktivitetsmåling. Dette er opprinnelig en metode brukt for å monitorere behandling med heparin, men den kan også brukes til å avdekke tilstedeværelse av Xa-hemmere i prøver. Interne utprøvninger har vist at metoden effektivt fanger opp Xa-hemmere, da tilstedeværelsen av disse legemidlene fører til en betydelig økning i anti-faktor Xa-aktivitet selv ved lave konsentrasjoner. Dette gjør det også mulig å skille mellom heparin og Xa-hemmer i prøven, ettersom heparin i terapeutiske doser ikke vil gi like høy anti-faktor Xa-aktivitet som DOAK i terapeutiske doser (5, 6).
Ulike reagenser til måling av anti-faktor Xa-aktivitet har ulik følsomhet for DOAK Xa-hemmere, noe man må være oppmerksom på ved valg av reagens til dette formålet.
For å oppdage tilstedeværelse av IIa-hemmere (f.eks. dabigatran) er anti-faktor Xa-aktivitetsmåling uegnet, da disse ikke påvirker anti-faktor Xa-aktivitet. I stedet kan måling av APTT og trombintid benyttes, da tilstedeværelse av IIa-hemmere vil forlenge både APTT og trombintid. Virkningsmekanismen for IIa-hemmere er direkte hemming av trombin, som omdanner fibrinogen til fibrin i koagulasjonsprosessen. Spesielt trombintid vil bli sterkt forlenget ved tilstedeværelse av legemiddelet.
Vitamin K-antagonister (warfarin)
For å oppdage bruk av warfarin (Marevan ®), som er en vitamin K-antagonist, brukes PT-Quick (≈INR). Warfarin hemmer syntesen av de vitamin K-avhengige koagulasjonsfaktorene (faktor II, VII, IX og X), noe som resulterer i forlenget PT-Quick da denne analysen er følsom for mangel av disse. Dette gjør PT-Quick/INR til en pålitelig test for monitorering av warfarinbehandling og dermed også en egnet metode for å påvise warfarinbehandling hos pasienter hvor det er sendt prøver til utredning av økt trombosetendens.
Heparin
Det finnes to hovedtyper heparin: ufraksjonert heparin (UFH) og lavmolekylært heparin (LMWH). Begge kan påvises ved å måle anti-faktor Xa-aktivitet, og vil ved terapeutiske doser gi en mindre økning i aktivitet sammenlignet med DOAK (Xa-hemmere). Heparin vil også, i motsetning til DOAK, gi forlenget APTT og trombintid. Interne utprøvninger har vist at ulike konsentrasjoner av heparin gir en forutsigbar økning i både APTT og trombintid. Dette gjør det mulig å skille mellom UFH, LMWH og DOAK ved å sammenholde verdiene for APTT, trombintid og anti-faktor Xa-aktivitet.
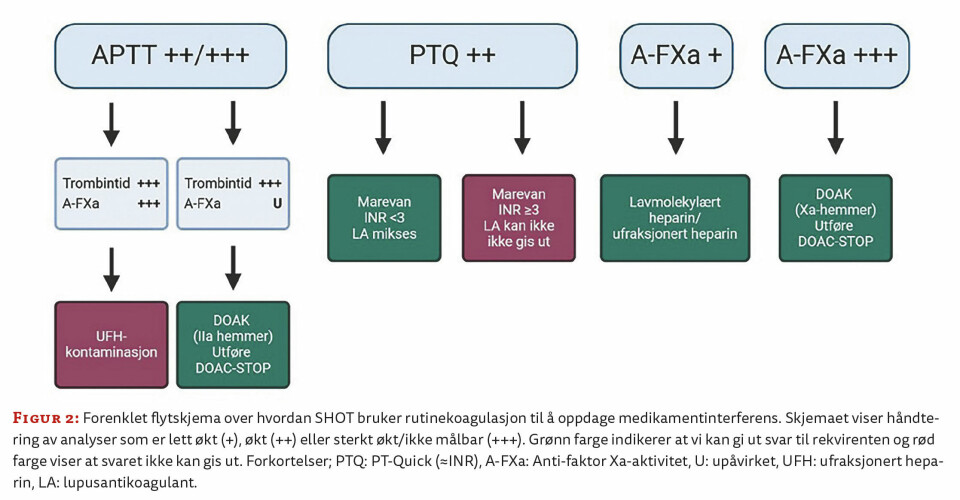
Basert på litteratur og egne erfaringer og utprøvinger har SHOT utarbeidet et flytskjema som benyttes ved tromboseutredning (figur 2).
Effekten av antikoagulantia på tromboseanalyser
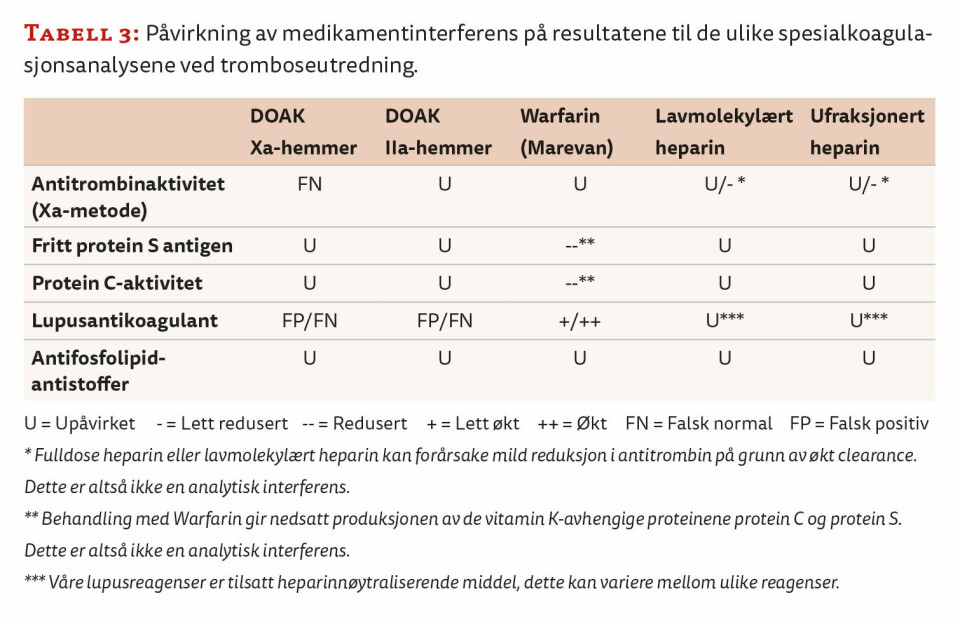
Årsaken til at vi utfører en omfattende preanalytisk screening, er at tilstedeværelse av antikoagulantia kan gi feilaktige analyseresultater. Hvordan de ulike analysene påvirkes, avhenger av både metoden og reagensene som benyttes. I tabell 3 er det gitt en oversikt over hvordan ulik medikamentinterferens påvirker våre analyser ved tromboseutredning.
DOAK
Tilstedeværelse av DOAK kan gi både falsk positive og falsk negative resultater i lupusantikoagulant-analysene (7), og i utgangspunktet kan ikke svarene gis ut dersom DOAK påvises i prøven. Tidligere måtte man seponere DOAK hvis man ønsket svar på lupusantikoagulant, men nå utfører vi DOAC-STOP. Dette er en metode hvor man nøytraliserer DOAK i prøven ved å tilsette et reagens (i tablettform) som danner et kompleks med medikamentet. Etter sentrifugering kan man benytte supernatanten for analysering på vanlig måte. Studier viser at DOAC-STOP effektivt fjerner interferensen fra DOAK uten å påvirke resultater ved spesialkoagulasjonsanalyser (8).
Vi utfører også DOAK-STOP dersom pasienten bruker DOAK (Xa-hemmer) og det er rekvirert antitrombinaktivitet. Dette fordi vi benytter oss av en antitrombinmetode som baserer seg på hemming av faktor Xa-aktivitet i reagenset. DOAK (Xa-hemmer) kan gi falskt for høy antitrombinverdi på grunn av hemming av Xa-aktiviteten i selve metoden, og dermed maskere en mangel eller dysfunksjon. Bruk av DOAK (Xa-hemmer) vil ikke interfere i en antitrombinmetode basert på faktor IIa-aktivitet, men i slike metoder vil en DOAK IIa-hemmer interferere (9, 10).
Vitamin K-antagonister (warfarin)
Når det gjelder pasienter som behandles med warfarin (Marevan®), må vi tilpasse våre lupusantikoagulant-analyser ut ifra INR-verdi. Dersom INR er høyere eller lik 3, er interferensen for stor, og svar kan ikke gis ut. Ved INR mindre enn 3 kan tilstedeværelse (påvist/ikke påvist) av lupusantikoagulant vurderes etter utførelse av en mixing-test. Lupusantikoagulant måles da i en 1:1-blanding av pasientplasma og normalplasma. Mixing med normalplasma vil føre til at faktormangelen indusert av warfarin korrigeres. Siden warfarin er en vitamin K-antagonist, påvirkes også nivåene av de vitamin K-avhengige koagulasjonshemmerne Protein S og Protein C ved at de blir lavere. Dette må tas i betraktning når man tolker resultatene hos pasienter som behandles med warfarin (11).
Heparin
For pasienter som bruker heparin i terapeutiske doser, kan vi gi ut analyseresultater når metodene som i utgangspunktet er følsomme for heparininterferens, er tilsatt heparinnøytralisator. Blant metodene vi benytter til tromboseutredning er det lupusantikoagulant som er følsom for heparininterferens. Våre lupus-reagenser er tilsatt heparinnøytralisator og hvis anti-faktor Xa-aktivitet ikke overstiger grensene produsenten oppgir, kan svaret gis ut. Hvor mye heparin ulike metoder/reagenser tåler, kan variere, og det er viktig at laboratoriet har oversikt over egne metoder.
Heparinkontaminasjon fra prøver tatt fra dialysekatetre eller sentrale venekatetre (CVK) kan være en utfordring. Selv om saltvannsskylling og bruk av kasteglass benyttes, kan heparin fortsatt forurense prøven. Dette kan gi suprafysiologiske nivåer av heparin og påvirker flere koagulasjonsanalyser. Ved mistanke om heparinkontaminasjon gir vi ikke ut resultater, men ber om nye prøver.
Konklusjon
Antikoagulantia utgjør en utfordring for tolkning av koagulasjonsanalyser, da deres tilstedeværelse kan påvirke analyseresultater. Spesielt har den utstrakte bruken av DOAK introdusert nye utfordringer ved utredning av økt trombosetendens, noe som gjør den preanalytiske vurderingen enda viktigere.
For å sikre nøyaktige analyseresultater, må vi på laboratoriet:
- Ha en god forståelse av de lokale reagensene, ettersom følsomheten for medikamenter kan variere mellom ulike metoder og leverandører
- Implementere strategier for å oppdage medikamentinterferens, spesielt DOAK, for å kunne gi korrekte svar på spesialkoagulasjonsanalyser
- Sørge for at informasjon om interferensproblematikk ved medikamentbruk er lett tilgjengelig for rekvirenter
Ved SHOT utføres et omfattende detektivarbeid i den preanalytiske vurderingen. Dette er en ressurskrevende prosess som ikke alle laboratorier har kapasitet og mulighet til å gjennomføre. En effektiv tilnærming kan være å bruke rutineanalyser til først å identifisere prøver med medikamentinterferens, før kostbare spesialanalyser utføres. Alternativt kan standardkommentarer i analyserapportene hjelpe rekvirenten med å tolke resultatene.
Gjennom vårt store prøvevolum har vi samlet bred kompetanse og erfaring med preanalytiske feilkilder i spesialkoagulasjonsanalyser, en utfordring som er relevant for alle sykehuslaboratorier. Vi håper at våre erfaringer kan være nyttige for andre laboratorier.
Takk
Takk til Carola Henriksson, overlege/seksjonsleder, Avdeling for medisinsk biokjemi, Seksjon for hemostase og trombose, OUS, for å ha delt sin kompetanse og erfaring i forbindelse med skrivingen av denne artikkelen. Videre en stor takk til personalet på SHOT, Rikshospitalet, for godt faglig samarbeid.



























