FAG i praksis
DPYD-genotyping – erfaringer fra Haukeland universitetssjukehus
Genvarianter kan ha stor betydning for dosering av legemidler. Genotyping avDPYDble anbefalt som obligatorisk før oppstart av behandling med fluoropyrimidiner i 2020. Året etter ble den første farmakogenetiske analysen innført ved Haukeland universitetssjukehus (HUS).
DPYD-genotyping – erfaringer fra Haukeland universitetssjuke-hus.pdf(366 KB)
Av ANNE NISTAD, TORMOD KARLSEN BJÅNES og MARTA VORLAND
Fluoropyrimidiner er en legemiddelgruppe som blant annet består av 5-fluorouracil (5-FU), kapecitabin og tegafur, og benyttes i behandlingen av flere ulike kreftformer, blant annet kolorektal- og brystkreft. Enzymet dihydropyrimidin dehydrogenase (DPD) er sentral i den inaktiverende metabolismen av slike legemidler (1). Manglende eller redusert funksjon av enzymet gir alvorlige bivirkninger.
Enzymet kodes av genet DPYD, og genotyping av dette genet ble nylig anbefalt som obligatorisk før oppstart av behandling med fluoropyrimidiner (2). Hensikten er å oppdage kjente genvarianter som medfører redusert eller manglende aktivitet i DPD, for å forebygge risiko for alvorlige overdoseringer og potensielt dødelige utfall som følge av bivirkninger i tarm, hud og beinmarg.
Hos inntil 60% av pasienter som utvikler alvorlige bivirkninger av 5-FU, er redusert DPD-aktivitet angitt som en sentral årsak. Deteksjon av genvarianter som gir redusert eller manglende aktivitet er dermed et viktig bidrag til pasientsikker-heten, slik at oppstartdosen kan reduseres eller et annet legemiddel velges. Det er internasjonal og nasjonal enighet om hvilke genvarianter som bør inngå i rutinemessig DPYD-genotyping, samt hvilke kliniske konsekvenser funnene har (3, 4).
Ved Kreftgenomikk på HUS innførte vi genotyping av DPYD høsten 2021 i samarbeid med Avdeling for medisinsk biokjemi og farmakologi. I denne artikkelen presenterer vi metoden vi bruker og våre erfaringer med etablering og drift av analysen.
DPYD-genvarianter av klinisk betydning
Det er store forskjeller i DPD-enzymaktivitet mellom individer. En rekke genvarianter av betydning for enzymaktivitet er påvist, men den kliniske relevansen er i mange tilfeller ikke avklart. Det er så langt funnet fire DPYD-genvarianter der det er en tydelig sammenheng med klinisk relevant endring i DPD-enzymaktivitet som har betydning for dosering av fluo-ropyrimidiner (3). To av variantene gir et inaktivt enzym, mens de to øvrige gir redusert funksjon (tabell 1).
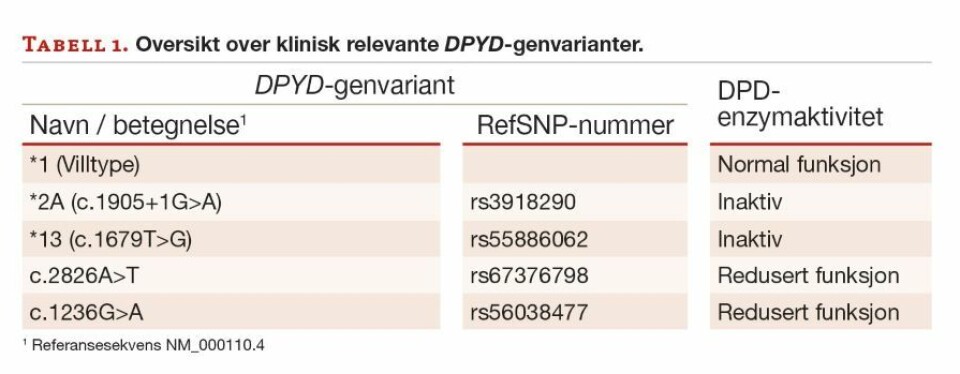
Dersom det påvises inaktive varianter i begge alleler (homozygot), har pasienten trolig fullstendig manglende DPD-enzymaktivitet. Da må all bruk av fluoropyrimidiner unngås. Dette er svært sjelden (<0,5%), men ulike kombinasjoner av varianter (homozygote eller heterozygote) som gir redusert enzymaktivitet finnes hos 3 – 9 % av den kaukasiske befolkningen (5). Veiledende råd om reduksjon av dose gjelder ved oppstart av behandlingen. Men fordi det også innenfor samme genotype er stor variasjon i DPD-aktivitet, må den videre doseringen tilpasses individuelt basert på effekt og bivirkninger. Hos noen pasienter trengs ytterligere dosereduksjon, mens andre kan tåle normal dose (3).
DPYD-genotyping med LAMP og smeltepunktsanalyse
Vi utfører genotyping av DPYD ved hjelp av Loop-mediated isothermal amplification (LAMP). LAMP-metoden er en isoterm teknikk for DNA-amplifisering, der det benyttes en spesifikk DNA-polymerase som ikke er sensitiv for inhibitorer som finnes i blodet. Derfor trenger man ikke å bruke renset DNA i reaksjonen, men kan benytte lysert EDTA-blod. Polymerasen har i tillegg høy aktivitet og evnen til å separere dobbeltrådet DNA, noe som eliminerer behovet for det varmedenaturerende trinnet som benyttes ved PCR-reaksjoner. Amplifiseringen kan derfor foregå ved en konstant temperatur, typisk 65°C grader. Spesielt for metoden er at den også inneholder minst tre primerpar som gir økt sensitivitet og spesifisitet, sammenlignet med standard PCR-reaksjoner. Selve LAMP-reaksjonen er todelt. Først dannes en 2-loop-struktur som senere er utgangspunktet for DNA-syntesen (figur 1). Dette gir DNA-amplifisering med svært høyt utbytte på kort tid.
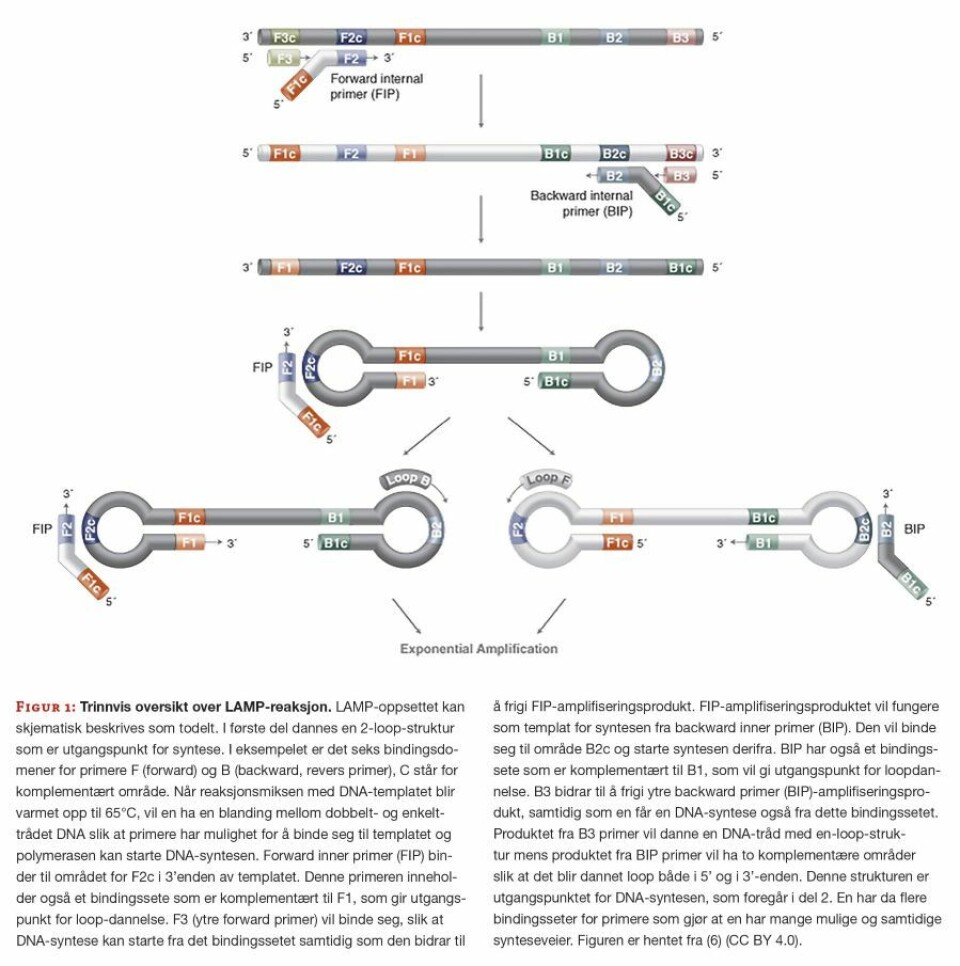
Amplifiseringsproduktene fra LAMP-reaksjonen har forskjellig lengde, avhengig av bindingssetet for primeren. Felles for alle produktene er at de inneholder området som skal undersøkes (7).
Etter amplifisering utføres smeltepunktsanalyse med sekvensspesifikke fluorescensprober og quenchere (figur 2).
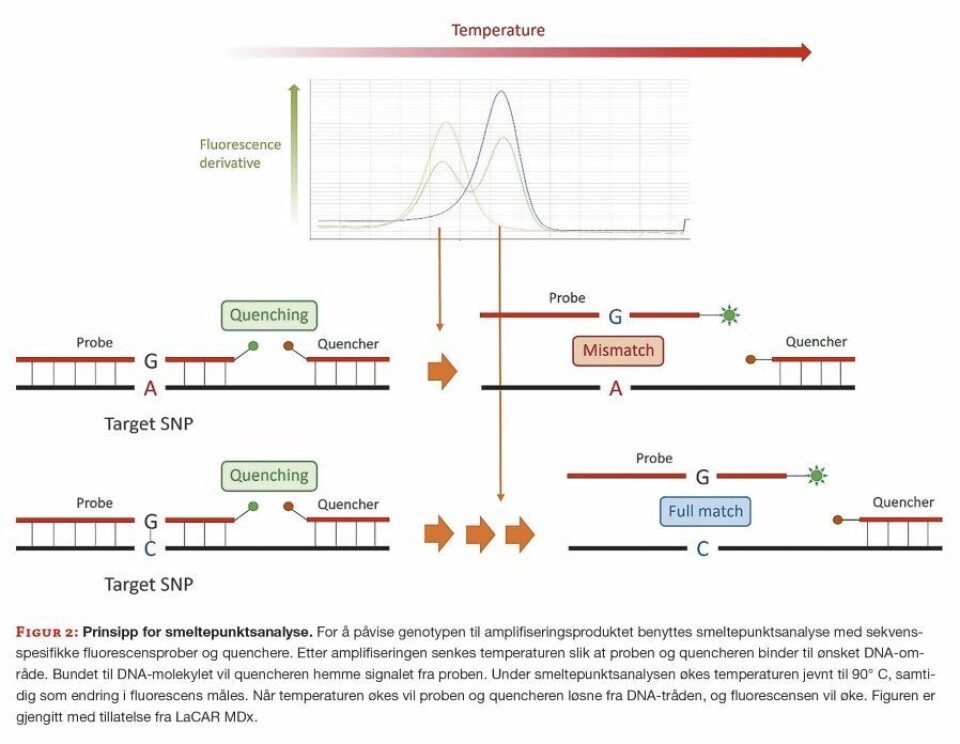
Ved å måle endringen i fluorescens, kan man bestemme hvilken genotype pasienten har. Proben er designet til å binde eksakt til enten villtype eller mutert allel. Det allelet som proben er designet for vil ha høyest smeltepunkt, siden bindingen mellom proben og DNA-et da vil være sterkest. Derfor vil smeltepunktene og smeltekurvene for hver av variantene være forskjellige, avhengig av om pasientprøven har villtype, heterozygot eller mutert genotype.
Analyse av DPYD-genvarianter
Vi bruker et analysekit fra produsenten LaCAR MDx til analyse av DPYD. Analysekittet inneholder reagens for å analysere de fire DPYD-genvariantene som er listet i tabell 1. LAMP-metoden er ikke avhengig av renset DNA, noe som gjør den spesielt egnet om en ikke har helautomatisert DNA-ekstraksjon tilgjengelig i laboratoriet. EDTA-blod blir først lysert med en lyseringsbuffer på en egen plate, og lysatet blir så overført til de fire forskjellige reaksjonsbufferne som er fordelt på qPCR-plate. Smeltekurvene sammenlignes med standarder med kjente genvarianter for å bestemme pasientens genotype. Svaret utgis til rekvirenten som en genotype og en kommentar om antatt enzymaktivitet og eventuelt anbefalt startdose av fluoropyrimidiner.
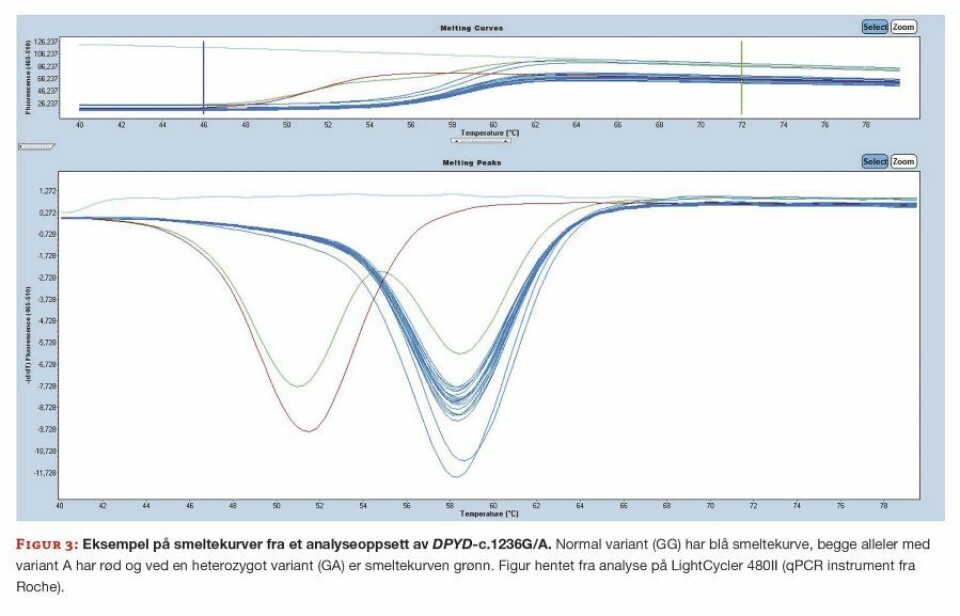
Figur 3 viser resultatet fra et analyseoppsett for DPYD-varianten c.1236G>A. Her er proben i analysekittet designet til å hybridisere med villtypefragmentet, og pasientprøver med normal variant (G) vil få et høyere smeltepunkt enn prøver med base A i samme posisjon. Prøver som får påvist heterozygositet (GA), har ett allel med normal aktivitet og ett allel med redusert aktivitet. Disse prøvene vil derfor ha to smeltepunkt.
To år med DPYD-genotyping
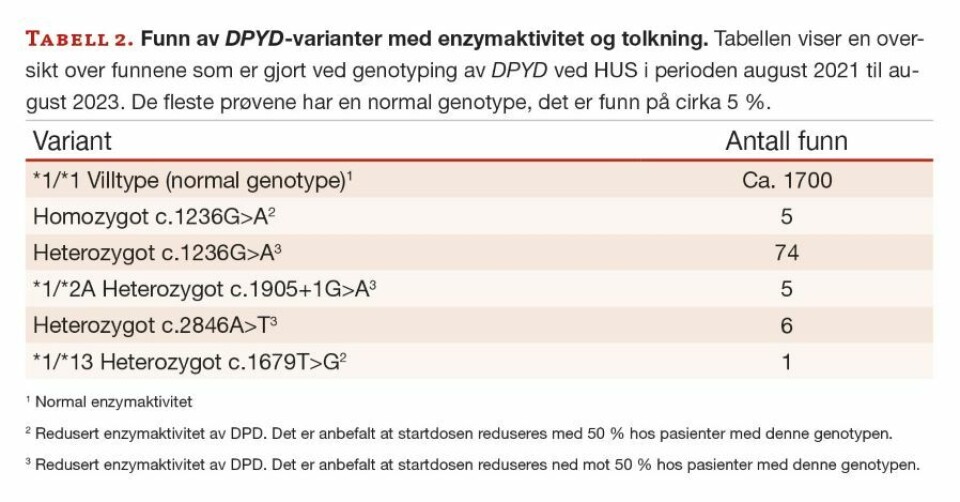
DPYD-analysen har vært i rutinedrift ved Kreftgenomikk på HUS siden august 2021. Analysen blir satt opp på et fast tidspunkt en gang i uken. Vi vurderer å øke til to ganger pr uke, dersom behov og ressurser tilsier det. Siden oppstarten har vi utført DPYD-genotyping på cirka 1800 pasientprøver. LAMP-metoden har vist seg å være en stabil og god metode. Det har vært få problemer med analyseoppsettene, slik at rekvirenten har fått svarene sine til avtalt tidspunkt. De aller fleste prøvene har normal genotype. Hos pasientene som får påvist DPYD-varianter, er det den heterozygote formen av c.1236G>A som er det mest vanlige funnet (tabell 2). Totalt er det funn på cirka 5 % av prøvene, noe som stemmer godt med forekomsten i en kaukasisk befolkning (5).
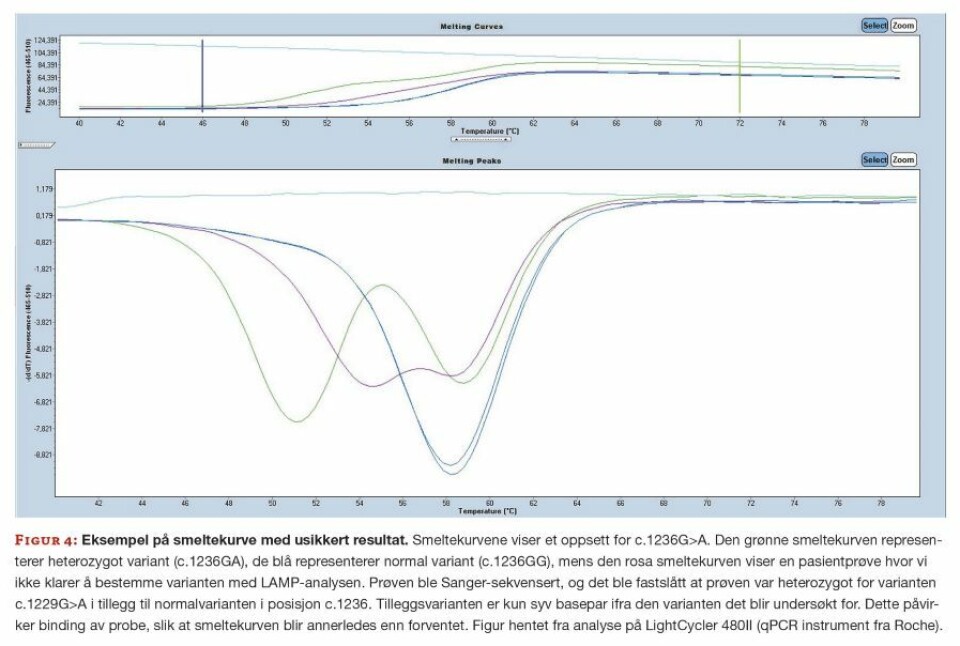
Metoden vi bruker påviser kun de listede variantene i tabell 1. Det er derfor viktig å ha en backup-metode som kan brukes når LAMP-metoden ikke kan fastslå genotypen, da rekvirenten er avhengig av et raskt svar for å kunne starte behandlingen. Dersom pasienten har andre varianter i umiddelbar nærhet til variantene listet i tabell 1, vil dette vises som ugjenkjennbare smeltekurver ved LAMP-oppsettet (figur 4). I slike tilfeller må andre metoder benyttes for å kunne fastslå varianten med sikkerhet, vi utfører da Sanger-sekvensering av aktuelle genområder.
Genvariantene som detekteres ved genotyping av DPYD er medfødte, og et svar på denne analysen kan derfor sees på som endelig. Ved rekvirering av DPYD-genotyping på en pasient der svar allerede foreligger, vil analysen bli automatisk besvart med tidligere resultat. Dette sparer ressurser når reanalysering ikke er nødvending. Dersom det er mistanke om prøveforbytting eller annen gyldig årsak til å få utført analysen på nytt, kan rekvirent be om dette spesielt.
Avslutning
Vi har delt våre erfaringer med innføring av DPYD-genotyping ved Kreftgenomikk. Analysevolumet tilsier at dette er en etterspurt analyse som kan utføres lokalt. Rekvirenten får raskere og tryggere svar fordi prøven ikke trenger å bli sendt ut av helseforetaket, og resultatet overføres elektronisk til journalsystemet (DIPS Arena). Et raskere svar gjør at pasienten tidligere kan starte opp med behandling, med en dose som er tilpasset DPYD-genotypen.
























