Fag i praksis
En aminosyreendring på histonhalen til histon 3 er en drivermutasjon for høygradig glioma hos barn
Epigenetiske mutasjoner på histonhalen til histon 3 har en avgjørende rolle i utviklingen av høygradig glioma hos barn. Nyere forskning argumenterer for at denne mutasjonen på et enkelt histon har en global påvirkning på epigenomet i cellen og genreguleringen på omkringliggende nukleosomer (1).
Av KAJA MARIENBORG, Bioingeniør, MSc. Universitetslektor ved Bioingeniørutdanningen ved OsloMet. Medlem i forskningsgruppen mot antibiotikaresistens ved Sykehuset i Vestfold
Høygradig glioma (HGG) hos barn er sjeldent (< 1 av 100 000), men har til gjengjeld en svært dårlig prognose hvor de fleste sjelden overlever mer enn fem år etter diagnosetidspunktet (2). HGG hos barn (pHGG) har et ulikt mutasjonsmønster og sykdomsforløp enn hos voksne, som gir pHGG den mest alvorlige graderingen (grad 4) etter Verdens Helseorganisasjons graderinger (2, 3).
Tradisjonelt har HGG blitt karakterisert via histopatologiske metoder, men de siste års vekst i molekylærgenetiske metoder har endret klassifiseringen (2, 3). Særlig de epigenetiske mutasjonene viser helt spesifikke forskjeller hos HGG mellom barn og voksne, og riktig klassifisering av tumor er essensielt for riktig diagnose og persontilpasset behandlingsforløp (3). Mutasjon i halen av histon 3, hvor lysin nummer 27 blir til en metionin (H3K27M) blir påvist i mer enn 70% av alle HGG hos barn. Det er tilstedeværelse av denne mutasjonen som klassifiserer denne type HGG til en grad 4 tumor (3-6). Sammen med H3K27M-mutasjonen sees ofte mutasjoner i TP53, som er et tumorsuppressorprotein og helt avgjørende i cellesyklus og apoptose (3).
Epigenetisk regulering
Epigenetikk er et forholdsvis nytt fagfelt og mye er fortsatt ukjent. Siden 1942 har definisjonen av epigenetikken endret seg flere ganger (7) og i dag finnes flere definisjoner med små variasjoner. En godt anerkjent definisjon er Adrian Bird sin definisjon fra 2007: «the structural adaptation of chromosomal regions so as to register, signal or perpetuate altered activity states» (8), fritt oversatt til «den strukturelle tilpasningen av kromosomregioner for å registrere, signalisere eller opprettholde endrede aktivitetstilstander».
De foreløpig beskrevne epigenetiske regulatorer er: DNA-modifikasjoner, histonvarianter, histon- og histonhalemodifikasjoner, leser-, skriver- og viskeenzymer og ikke-kodende RNA (7, 9, 10). I kroppens forskjellige vev og gjennom et menneskeliv vil de epigenetiske merkene variere og endre seg, men i meiosen starter man med blanke ark (8, 10, 11). Som et ledd i meiosen vil de epigenetiske merker fjernes fra DNAet slik at et fullstendig DNA kan fordeles til kjønnscellene og et nytt kjønnsspesifikt epigenetisk avtrykk avsettes (7, 8, 10).
I de første ukene etter befruktningen vil en på ny få en reduksjon av epigenetiske markører frem til blastocysten er etablert (7, 8, 10). Etter hvert som de pluripotente stamcellene differensieres til spesifikke celletyper, vil spesifikke gener skrus av og på ved hjelp av DNA-metylering. DNA-metyleringen finner sted i nærheten av, eller i såkalte CpG-øyer (7, 11). Etter hvert som cellene differensieres vil DNA-tråden kveiles rundt nukleosomer bestående av histoner, og metylerte områder pakkes bort (figur 1 og 2).
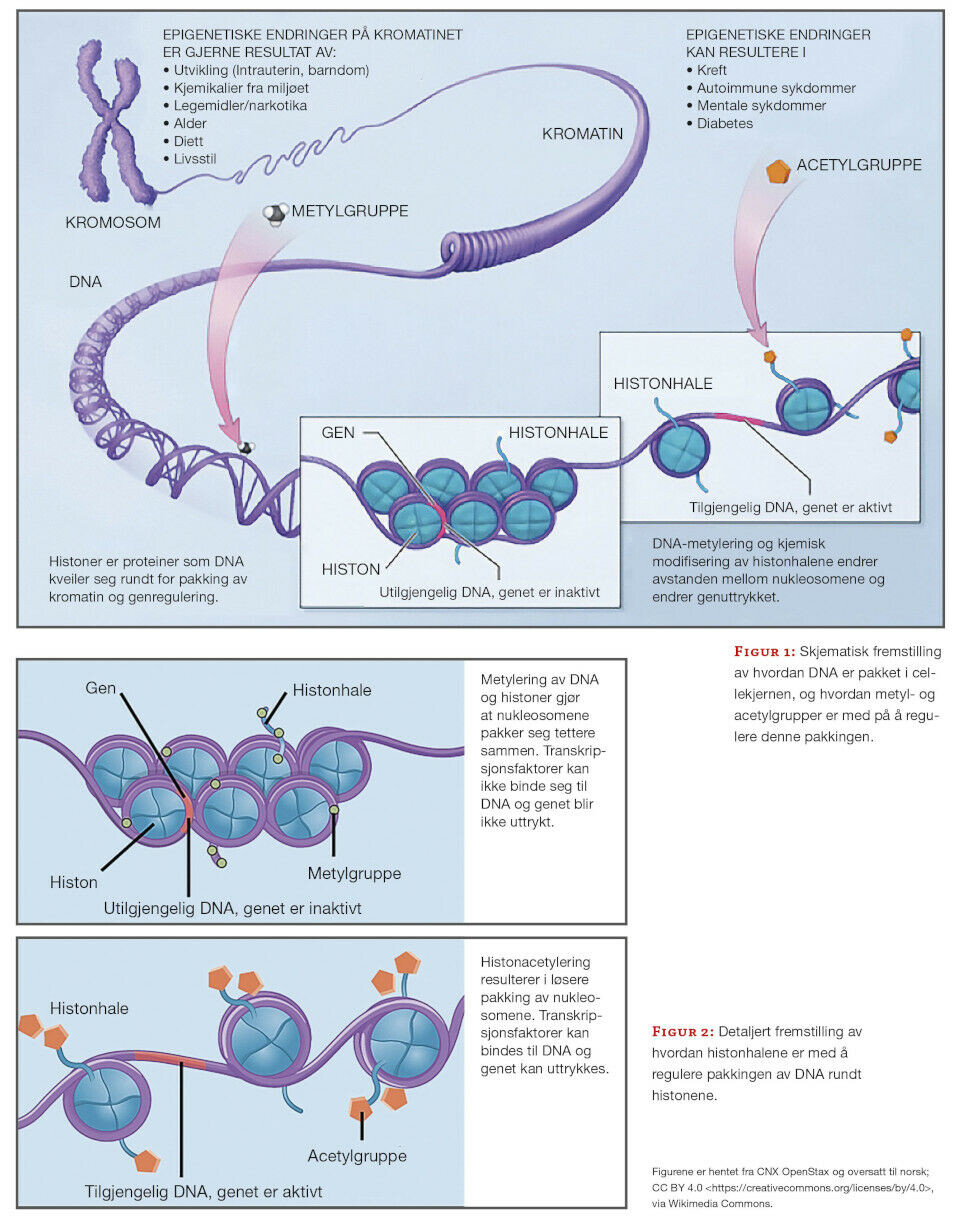
Sammensetningen av histoner og metylering av histonhalene er avgjørende for kromatinpakkingen og tilgjengeligheten til DNA og gener (10). Her spiller metylering og acetylering av histonhalene en stor rolle. Heterokromatin er den delen av kromatinet som pakkes tett sammen slik at genene ikke er tilgjengelige for transkripsjon. Eukromatin er den delen av kromatinet som transkriberes ofte og er lettere pakket. Såkalt de novo kromatinetablering er viktig for fosterutviklingen og den videre differensieringen av celletypene (10, 12).
De åtte ulike histonene som utgjør et nukleosom har hver sin aminosyrehale, og metylering og acetylering av blant annet lysinene på histonhalene er med å regulere pakkingen av DNA-tråden rundt nukleosomene (10). Hvor hardt DNA pakkes rundt nukleosomet reguleres av lesermolekyler. Metylering og acetylering av de ulike aminosyrene på histonhalene signaliserer om et kromatinområde skal åpnes eller pakkes (13). På halen til H3 er trimetylering av lysin nummer 4 (K4me3) et merke for høy aktivitet, en slags gasspedal (13). Trimetylering av lysin nummer 27 (K27me3) er merket for inaktivitet, en slags brems. Disse merkene kan forekomme samtidig, da er kromatinområdet klart til transkripsjon, men transkripsjonskomplekset er ikke rekruttert (14). Mono-, di- og trimetylering av lysin nummer 36 (K36 me1/2/3) er merker for genaktivering, og forekommer gjerne i nærheten av eksonrike områder og indikerer trolig start og stopp av et gen (13). Trimetylering av lysin nummer 9 (K9me3) fungerer som en håndbrems og vil signalisere tettere pakking av kromatinet (1).
Videre vil K27ac1/2/3 signalisere økende transkripsjonsaktivitet av ett område, litt som et speedometer i en bil (1). Alle disse merkene leses av ulike enzymkomplekser, som vil aktivere pakking, åpning eller transkripsjon i området. Polycomb (PRC2) enzymkompleks er et slikt leserenzym som aktiverer tettere pakking av kromatinet rundt nukleosomet (5, 6, 15). En mutasjon i histonhalen til H3.3 vil kunne påvirke aktiviteten av PRC2 og dermed den videre pakkingen av kromatinet (1, 6, 12, 14).
H3K27M er en drivermutasjon for onkogenesen av pHGG
Siden 2010 har flere studier vist at H3K27M er til stede i 70% av HGG hos barn (4-6). De samme studiene viser også at denne mutasjonen er svært onkogen og alene kan føre til utvikling av HGG i svært tidlig alder (4-6). Selv om det er flere gener som koder for H3, trengs bare ett mutert H3-gen for at effekten av H3K27M skal påvirke den globale epigenetiske reguleringen av posttranskripsjonelle modifiseringer i cellen (4, 6). Denne genotypen er følgelig dominant. En studie fra 2013, konkluderte med at H3K27M kun påvirket den posttranskripsjonelle modifiseringen uten å påvirke de genaktiverende histonmerkene på H3K36 (5). En senere studie antyder at det i tillegg til H3K27M-mutasjonen, forekommer koordinerende endringer i histonhalenes genaktiverende metyleringer av H3K36 og acetyleringer av H3K27 (6).
I en ny studie fra 2020 teoretiserte Harutyunyan og hans kolleger at H3K27M-mutasjonen påvirker hele cellens epigenom, som igjen gir den onkogendrivende effekten av denne enkeltmutasjonen (1). Den viste at H3K27M induserer en global ettnivå reduksjon av metyleringsmerker på alle metylerte H3K27, også de normale H3K27-halene i cellen. Videre viste de at de genaktiverende H3K36-metylerte områdene hindrer metylering av nærliggende H3K27. Altså, at metylering av H3K36 har en antagonistisk effekt på metyleringen av H3K27. De fant også at i områdene hvor H3K27 me2 og me3 avtar, er det en moderat økning i metyleringen av H3K9 i korrelerende områder i epigenomet (1). I tillegg ser det ut til at H3K27M reduserer effektiviteten av PRC2-komplekset (1).
Dominant onkogen histonmutasjon
Harutyunyan og hans kolleger benyttet seg av ulike isogenetiske cellelinjer fra pHGG-pasienter, med og uten H3K27M- mutasjonen. Videre undersøkte de H3K27-metylering og interaksjonen med både H3K36- og H3K9- modifikasjoner i epigenomet (1). Ved å benytte en teknikk med kromatinimmunpresipitering og sekvensering (ChIP-seq) viste de at H3K27M fører til en gjennomgående ett-trinns demetylering av alle metylerte H3K27 i hele epigenomet. Videre viste de med kvantitativ massespektrometri (MS), en gjennomgående reduksjon i alle metyleringsgrader av H3K27, ved å sammenligne H3K27M-positive og -negative cellelinjer. Dette funnet samsvarer med en studie av Sarthy med flere, som med en Drosophila-modell fant en drastisk reduksjon i H3K27-metyleringer i de muterte cellelinjene (12). Dessuten viste de at reduksjonen i H3K27-metyleringsmerker er gjennomgående i epigenomet i de humane cellelinjene de studerte. Den samme globale reduksjonen finner også Phillips og Krug og deres kolleger i sine studier (6,14).
H3K36-metyleringer hindrer H3K27-metyleringer
I gjennomgangen av H3K36me2-metyleringer, viste MS-resultatene at disse merkene forblir relativt uforandret mellom de testede cellelinjene (1). Ved å slå ut histonmetyltransferasene; Nuclear Receptor Binding SET Domain Protein 1 og 2 (NSD1 og -2), viste studien at når H3K36-metyleringen avtar, øker H3K27-metyleringen. Videre viste MS-resultatene at i områder med tap av H3K27me2 og me3, oppstår en økt kompenserende metylering av H3K9me3.
I en oversiktsartikkel fra 2020 viser flere studier på H3K27M-cellelinjer en økning i H3K36me2 i områder hvor H3K27me3 er borte (6). Dessuten nevner de hvordan H3K9me3 øker i samsvar med en økning i H3K36me3. I en studie fra 2021 foreslår forfatterne at manglende heterokromatin og H3K27me3 i H3K27M-cellelinjer, øker H3K36me2 og me3 som er kjent for eukromatin (14). På denne måten skapes det grenser for H3K27-metylering via redusert aktivitet av PRC2.
Reduksjon av PRC2-aktivitet
Den reduserte aktiviteten til PRC2 kan være forårsaket av en irreversibel hemming av enzymkomplekset, grunnet en kombinasjon av de globale konsekvensene av H3K27M (1). Tidligere er det foreslått at H3K27M-mutasjonen immobiliserer enzymet som er den aktive delen av PRC2-enzymkomplekset metyltransferase enhancer of zeste 2 (EZH2). Man mener at denne immobiliseringen forårsaker den globale reduksjonen av metyleringer på omkringliggende umuterte H3K27 (4, 5).
Seinere studier viser at H3K27M-mutasjonen irreversibelt svekker EZH2 og derfor gir en mindre effektiv PRC2 (6, 12, 14). Videre foreslår man at den reduserende effekten av PRC2 forårsakes av at H3K27M blokkerer EZH2 sin evne til autometylering, altså EZH2 sin evne til å metylere seg selv. Dette reduserer effekten av PCR2-kompleksene og uunngåelig bidrar til den onkogen effekten av H3K27M (12). Uansett, de overordnede mekanismene som forårsaker at PRC2 mister effektivitet er fortsatt ikke blitt tilstrekkelig testet eller forklart.
Konklusjon
Flere studier har vist at H3K27M har store konsekvenser for utviklingen og onkogenesen av høygradig glioma hos barn. Denne mutasjonen skjer tidlig i livet og markerer derfor et nytt kapittel i forståelsen av epigenetiske endringer ved kreftutvikling.
























