Av GRO GUNDERSEN, bioingeniør, MSc; VAHID BEMANIAN, Ph.d; ALEXANDER ENDRES, MD; STEPHAN BRACKMANN; MD, Ph.d; HEGE TUNSJØ, bioingeniør, Ph.d
E-post: Hege Tunsjø; hetu@oslomet.no
Kolorektal kreft og tarmens mikrobiota
Kolorektal kreft (kreft i tykk- og endetarm) er en av de hyppigst forekommende kreftformene både i Norge og resten av verden (1, 2). Insidensen har vært høy i mange år, men med en nedgang det siste tiåret, spesielt i de vestlige land (3). I Norge har vi derimot sett en klar økning de siste ti årene og i 2012 og 2018 lå Norge på topp i verden med prosentvis flest antall tilfeller av kolorektal kreft hos kvinner. Tall fra Kreftregisteret viser at det i 2018 var 4428 nye tilfeller av tykk- og endetarmskreft i Norge (2).
Risikofaktorer for utvikling av kolorektal kreft er overvekt, kosthold, tobakk/alkoholforbruk, inaktivitet, arvelige faktorer, inflammatoriske tarmsykdommer (IBD) som ulcerøs colitt og Crohns sykdom - og kanskje den viktigste; alder. Personer over 50 år har betydelig økt risiko sammenlignet med personer under 50 år (2).
Nyere forskning viser at det mikrobielle miljøet i tykktarmen (mikrobiotaen) også kan ha betydning for utvikling av kolorektal kreft. Selv om kunnskapsgrunnlaget for årsakssammenhenger fortsatt er mangelfullt, begynner man nå å få et bilde av hvilke mikrober som er sterkest assosiert med sykdommen.
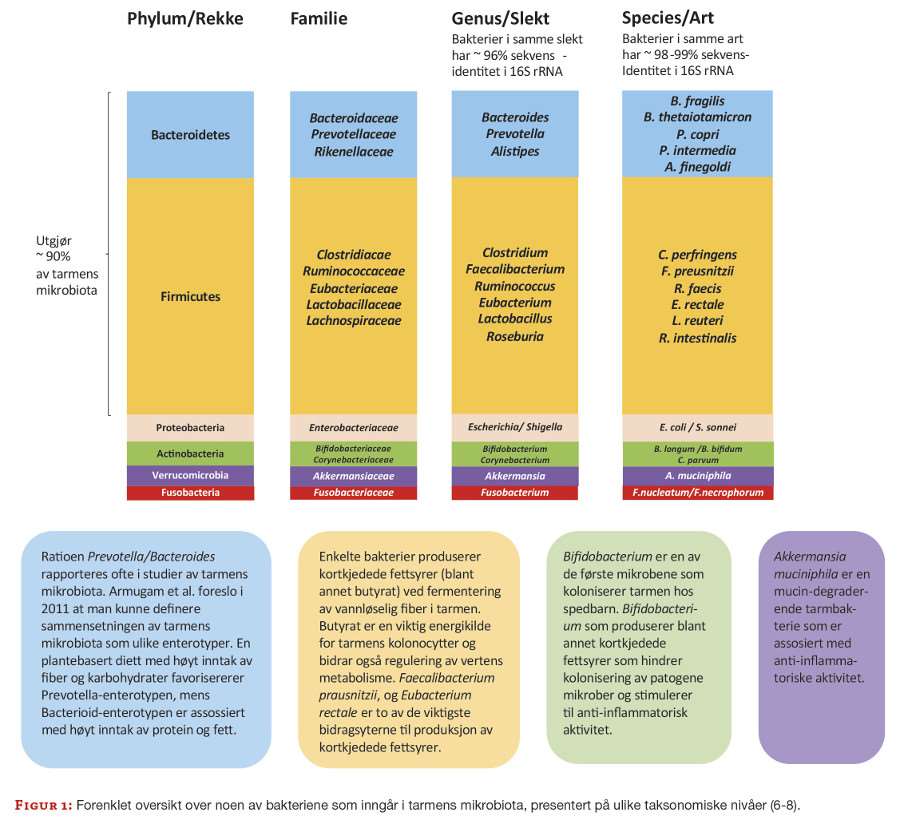
Ofte omtales en ubalanse, dysbiose, i tarmens mikrobiota som en risiko for flere tarmsykdommer, blant annet ved at enkelte mikrober kan stimulere til inflammasjon og forstyrre normal cellesyklus (4,5). Risiko for sykdom kan også være knyttet til redusert mangfold av mikrober og manglende aktivitet av fordelaktige bakterier. En rekke mikrober er ansett som gunstige i tarmen, blant annet gjennom produksjon av kortkjedede fettsyrer som både gir energi til tarmslimhinnens celler og stimulerer til et anti-inflammatorisk miljø (6). Figur 1 gir en forenklet oversikt over bakterier som inngår i tarmens mikrobiota. Det er imidlertid vanskelig å definere en «normal» tarmflora ettersom de individuelle variasjonene er store, og det er også påvist geografiske forskjeller (7,8).
Overlevelsesmulighetene ved tykk- og endetarmskreft er sterkt knyttet til sykdomsstadium på diagnosetidspunktet og det er derfor avgjørende å oppdage sykdommen tidlig. Ikke-invasiv testing for kolorektal kreft utføres i dag med immunokjemisk test for okkult blod (iFOBT) i feces, men testen er bare moderat sensitiv (9,10). Etablering av mikrobielle diagnostiske biomarkører for kolorektal kreft i feces kan bidra til å supplere iFOBT for seleksjon av pasienter til koloskopi, slik at diagnose kan stilles i tidlig sykdomsstadium. Målrettet behandling mot mikrober assosiert med kolorektal kreft er også løftet frem som nye behandlingsalternativer (11).
Metoder som benyttes i studier av mikrobiotaen
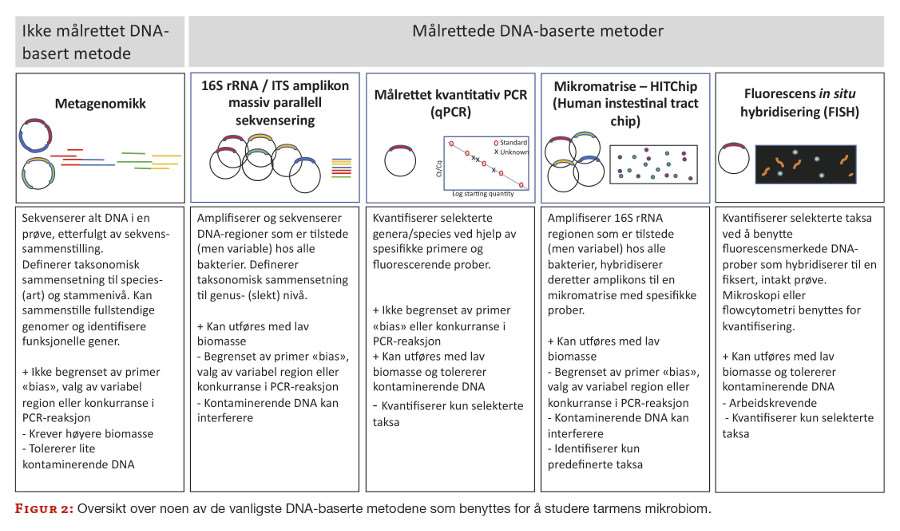
Den store interessen for tarmens mikrobiota har ført til mengder av publikasjoner i løpet av det siste tiåret. Feltet er foreløpig lite standardisert, det benyttes ulike metoder og mikrober rapporteres på ulike taksonomiske nivåer (phylum/rekke, familie, genus/slekt og species/art, figur 1), noe som kan gjøre sammenlikninger utfordrende. Det er derfor viktig å ha en oversikt over metoder som benyttes og kjenne til deres fordeler og begrensninger. Fordi det kun er en liten del av bakteriene i tarmen som er dyrkbare er det i hovedsak DNA-baserte metoder som dominerer, og det genetiske materialet i mikrobiotaen omtales som mikrobiomet.
Metoden med best oppløsning er såkalt metagenomikk, der alt DNA i en prøve sekvenseres (figur 2). Metagenomikk er imidlertid dyrt og arbeidskrevende. Den klart vanligste metoden som har vært benyttet frem til nå er derfor amplifisering og sekvensering av regioner som er til stede, men variable, hos alle mikrober, for eksempel gener som koder for 16S rRNA. Dette er en effektiv metode som ikke krever store mengder DNA, og som kan gi en oversikt over bakteriesammensetningen i et miljø.
Det er imidlertid en del variabler ved metoden som kan introdusere skjevheter mellom ulike protokoller. Genet som koder for 16S rRNA består av flere variable regioner, og valg av region for sekvensering har betydning for hvor godt metoden kan skille mellom ulike bakterier. Primere som benyttes til amplifisering av 16S rRNA har også stor betydning. En PCR som skal amplifisere flere bakterier vil alltid favorisere noen, slik at en korrekt gjengivelse av den bakterielle sammensetningen er vanskelig. Sinha et al gjorde i 2017 (12) en studie der de sendte kjente bakteriesammensetninger til 15 laboratorier for å undersøke variasjon mellom laboratorier. Resultatene viste at type prøvemateriale hadde størst effekt på variasjonen, deretter valg av DNA-ekstraksjon, PCR og sekvenseringsteknologi, og til slutt bioinformatisk analyse. Flere av laboratoriene viste store avvik fra fasiten. Dette illustrerer at det tar tid å standardisere nye metoder og innføre gode kontrollrutiner. Det er fortsatt en vei å gå for mikrobiom-studier.
Gjentatte funn i mange ulike studier er imidlertid god indikasjon på at aktuell(e) mikrobe(r) er assosiert med sykdom. Figur 2 viser en oversikt over de vanligste metodene som benyttes i studier av tarmens mikrobiom.
Økt forekomst av Fusobacterium nucleatum i tarmen hos pasienter med kolorektal kreft
Flere internasjonale studier har vist økte mengder av bakteriene Escherichia coli og Fusobacterium nucleatum i tarmen hos pasienter med kolorektal kreft (13-15). Det har imidlertid vært mangelfull dokumentasjon fra norske pasienter. Ved Akershus universitetssykehus ble det mellom 2014 og 2017 utført en pilotstudie på et utvalg norske pasienter med kolorektal kreft (16).
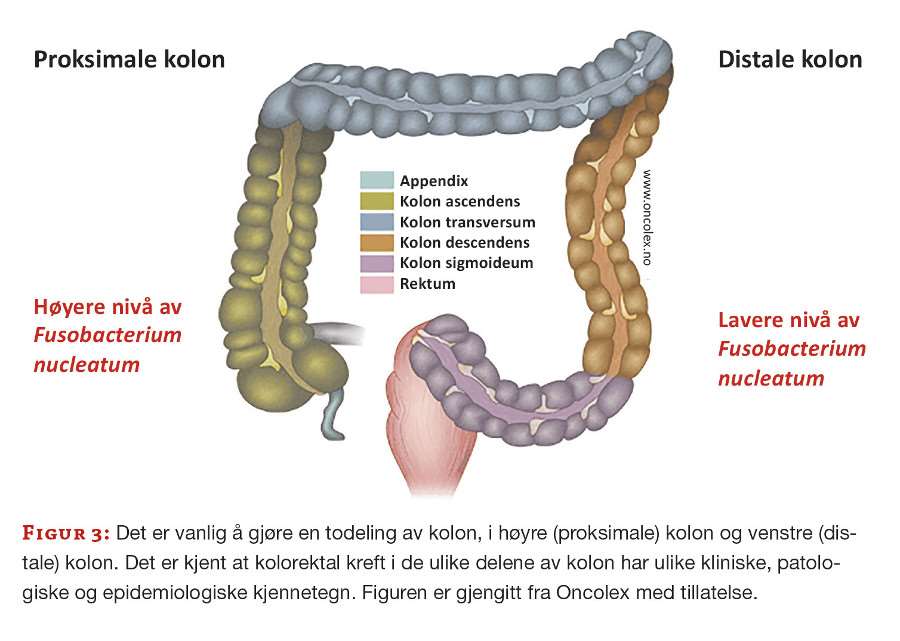
Studiekohorten besto av 72 pasienter som var innkalt til koloskopi på bakgrunn av symptomer eller funn ved CT-kolografi. Hver pasient samlet en fecesprøve i RNAlater RNA Stabilization buffer (Qiagen, Hilden, Germany) enten før tarmtømming eller én uke etter koloskopi. Under koloskopi ble det samlet biopsier (2 × 2 mm) fra ulike posisjoner i tarmen: 1) Kolon ascendens, 2) polypp eller tumorvev, 3) friskt vev nær tumor/polypp, 4) Kolon sigmoideum (figur 3). Etter undersøkelse og histologisk vurdering av patolog, ble pasientene inndelt i tre grupper; en gruppe med kolorektal kreft (n=25), en gruppe med adenomatøse polypper (n=25) og en kontrollgruppe uten patologiske funn (n=22). Median alder var 70 (kreft), 69 (polypp) og 57 år (kontroll).
Nivåer av genotoksiske E. coli og F. nucleatum ble undersøkt i feces- og biopsiprøver med kvantitativ PCR (qPCR). Utvalgte prøver ble videre studert med 16S rRNA amplikon-sekvensering med Illuminas NGS-teknologi (figur 2). PCR-resultatene viste ingen signifikant forskjell av E. coli toksingener mellom gruppene, verken i feces eller tarmbiopsier, mens nivåer av F. nucleatum var signifikant høyere i kreftgruppen sammenliknet med både kontroll- og polyppgruppen (figur 4).
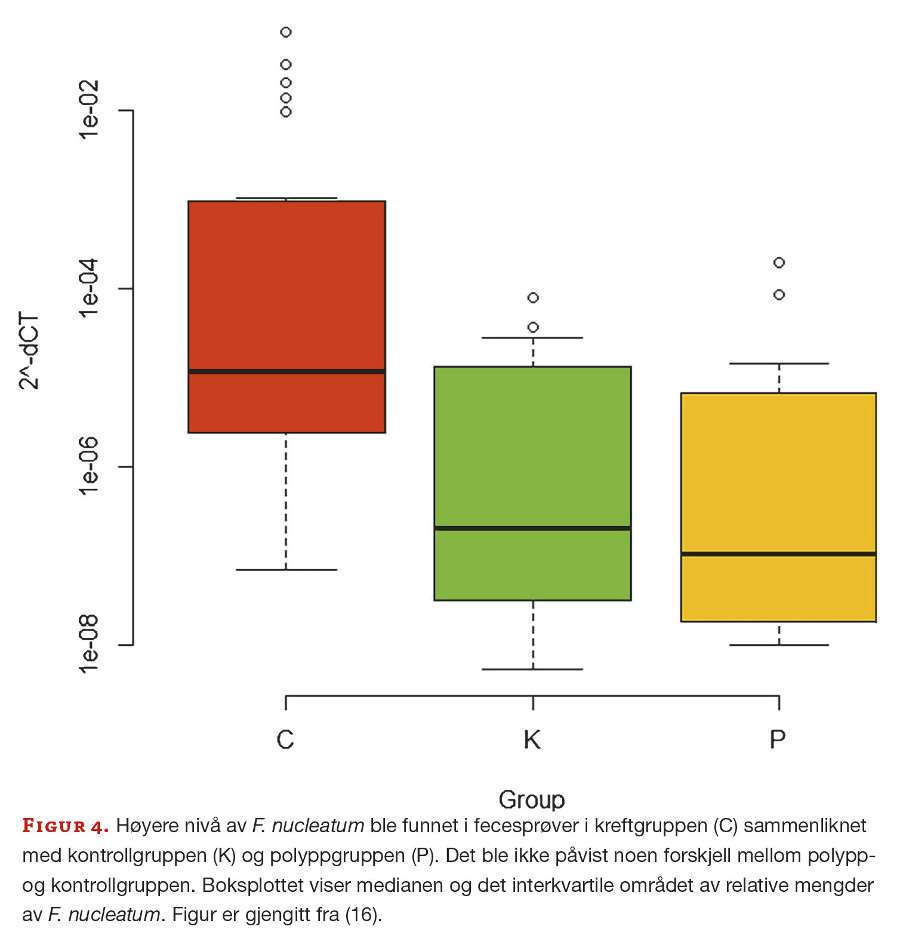
Relative mengder av F. nucleatum i hver prøve ble målt ved å benytte genet for 16S rRNA som referansegen og beregning av ΔCt-verdier (CtF.nucleatum − Ct16S rRNA). Introduksjon av en ΔCt cutoff på 12 kunne identifisere de kreftpasientene som hadde høye nivåer av F. nucleatum i feces, og fanget opp 35% av kreftpasientene i denne studien. Dette tallet er høyere enn det som er rapportert internasjonalt. Sett i lys av den høye forekomsten av kolorektal kreft i Norge så er dette en interessant observasjon (3). De høye tallene i vår studie kan også skyldes et lavt antall prøver som er inkludert i studien, og en utvidelse av arbeidet er i gang for å få et bedre grunnlag for tolkning.
Høye nivåer av F. nucleatum i feces gjenspeilet også deteksjon av F. nucleatum i tumormaterialet fra kreftpasientene. F. nucleatum ble påvist oftere og i flere posisjoner når tumor var lokalisert i høyre del av tarmen sammenliknet med venstre del (figur 3). Dette er i tråd med andre studier som har vist at andelen «F. nucleatum–high» -tilfeller av kolorektal kreft gradvis øker fra rektum og oppover til øvre del av kolon (17, 18). Våre resultater indikerer også hyppigere forekomst av en rekke molekylære endringer i tumorcellene ved høye nivåer av F. nucleatum. Disse inkluderer mikrosatellitt instabilitet (MSI) som forårsakes av inaktivering av DNA reparasjonssystemet (DNA mismatch repair). I tillegg ble det vist hyppigere aktiverende mutasjoner i onkogenet BRAF (manuskript under arbeid).
Hva vet vi om Fusobacterium nucleatum?
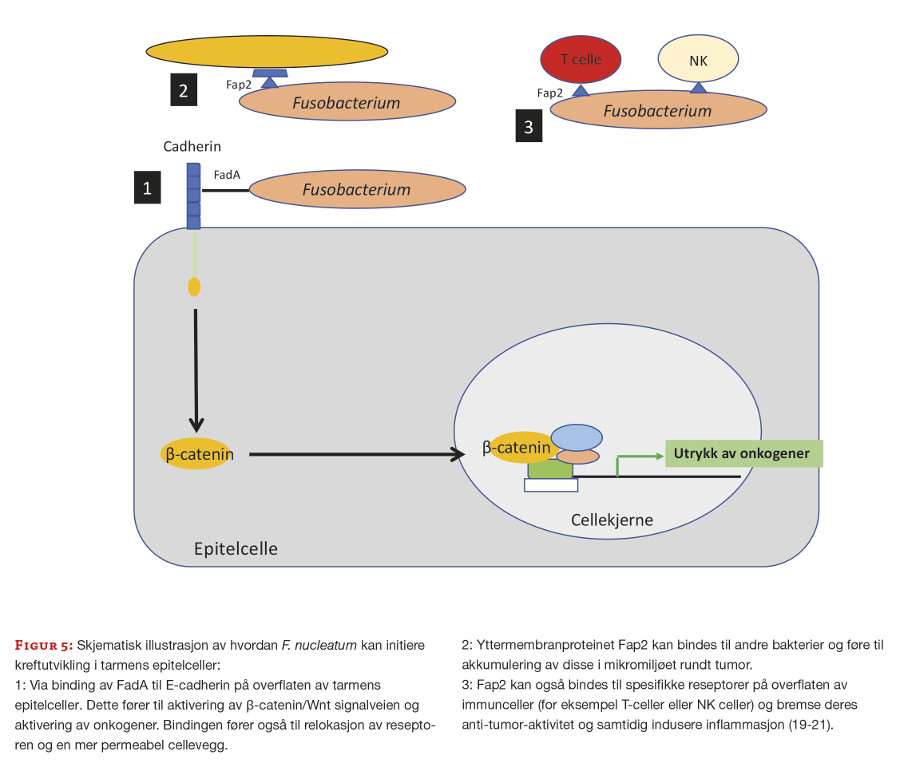
Fusobacterium nucleatum er en invasiv, strikt anaerob, gram-negativ bakterie. Mikroben har evne til å skape inflammasjon i tarmen og forstyrre det mikrobielle miljøet i og rundt tumor (tumor microenvironment (TME)). Dette har betydning for årsaksmekanismer for kreft som er sterkt knyttet opp til de inflammatoriske forholdene i tumor. F. nucleatum har også evne til å adherere og invadere eukaryote celler ved hjelp av to viktige proteiner; FadA og Fap2, som er rikelig uttrykt på bakteriens celleoverflate. FadA kan bindes til det ekstracellulære domenet av E-cadherin på overflaten av tarmens epitelceller. Dette resulterer i aktivering av Wnt-signalveien og fører til økt utrykk av flere onkogener (19, 20). Fap2 bidrar blant annet til å binde til og transportere andre ikke-invasive bakterier inn i tarmcellene, slik at de kan bidra i den karsinogene prosessen (21). Figur 5 gir en oversikt over hvordan F. nucleatum kan påvirke tarmens epitelceller.
Til tross for hypoteser om at F. nucleatum kan initiere kolorektal kreftutvikling, påviste vi ingen forskjell i nivåer av F. nucleatum i feces mellom gruppen med adenomatøse polypper og kontrollgruppen (figur 4). En alternativ hypotese er derfor at F. nucleatum opptrer tidlig, men etter initiering av kreftutvikling og er en risikofaktor for progresjon til avansert kreft. Det er også mulig at kun en undergruppe av polypper er “kolonisert” med F. nucleatum og utvikles videre til kreft. Studier har vist at invasive F. nucleatum er detektert i levermetastaser, noe som kan antyde en persisterende assosiasjon med tumorceller gjennom ulike stadier av kolorektal kreftutvikling (22).
Er andre Fusobacterium spp assosiert med kolorektal kreft?
Egne upubliserte data indikerer at andre Fusobacterium-arter enn F. nucleatum kan være overrepresentert i fecesprøver fra CRC-pasienter. Illumina MiSeq 16S rRNA amplikon-sekvenseringsdata indikerer at nær 50% av CRC-pasientene hadde økt forekomst av Fusobacterium på genusnivå (upubliserte data). Dette er en høyere andel enn det som ble påvist med qPCR som kun skal detektere F. nucleatum, og antyder at andre Fusobacterium-arter også kan være assosiert med kolorektal kreft. Det er foreløpig 14 arter og flere underarter i slekten Fusobacterium. Nylige studier har også foreslått at underarter av F. nucleatum bør klassifiseres som egne arter (23), noe som illustrerer at Fusobacterium-funnene i denne studien bør undersøkes nærmere og med metoder som gir enda bedre separasjon.
Nytteverdi av mikrobiomstudier
Selv om det mikrobielle miljøet i feces ikke er det samme som det man finner i tarmens slimhinne, kan det være god korrelasjon mellom flere bakterier i feces og vevsprøver fra tarmslimhinne. Feces kan dermed benyttes som et ikke-invasivt materiale for undersøkelse av disse mikrobene. Vår studie har vist at høye nivåer av F. nucleatum i feces kan ha potensial som en biomarkør for estimering av kreftrisiko og for deteksjon av kolorektal kreft i tidlige stadier. Ettersom de høye nivåene av F. nucleatum kun gjaldt for 35 % av pasientene, vil den foreslåtte tilnærmingen kun identifisere en andel eller en mulig subgruppe av pasienter med kolorektal kreft. Dette er gjenstand for videre studier i vår forskningsgruppe.
Vi har så langt fokusert på tidlig deteksjon av kolorektal kreft ved hjelp av bakterieprofiler. Imidlertid kan mer kunnskap om bakterienes mekanismer for initiering og/eller progresjon av tykktarmskreft også anvendes for å utvikle nye behandlingsmetoder. Et medikament som retter seg mot FadA og som kan blokkere bindingen mellom bakterie og epitelcelle, ville kunne forhindre bakteriens evne til å etablere seg i tumorvevet, og dermed også hindre aktivering av intracellulære prosesser og metastasering (24).
En annen behandlingsmulighet kunne være å redusere mengden av bakterier med antibiotika rettet mot F. nucleatum, som et tillegg til annen behandling (25). Ved en generell reduksjon av mengden F. nucleatum vil også den inflammatoriske situasjonen i tumor reduseres. Bekymring rettes allikevel mot effekten på normal tarmflora ved bruk av (bredspektret) antibiotika.
Det synes å være enighet om at tarmbakterier har stor betydning for utvikling av en rekke sykdommer, blant annet kolorektal kreft. Det gjenstår mye forskning på feltet, det vi vet i dag er trolig bare toppen av et isfjell. Vi ønsker å bidra til å drive dette feltet fremover.
Takk
En stor takk rettes til Genteknologisk seksjon, Avdeling for Tverrfaglig Laboratoriemedisin og Medisinsk Biokjemi og Avdeling for Gastromedisin, Ahus, for tilrettelegging og økonomisk støtte til prosjektet. Takk til bioingeniørstudenter ved OsloMet for bidrag i arbeidet.
Interessekonflikter: Ingen