FAG i praksis
Preanalytiske utfordringer i laboratoriemedisin
Preanalytisk fagsenter på Haukeland universitetssjukehus har som mål å øke kompetansen innenfor preanalyse. Det skal gjøres både med informasjon og forskning.
Laboratorium for klinisk biokjemi (LKB) ved Haukeland universitetssjukehus har et bredt fagmiljø som over flere år har opparbeidet kunnskap om preanalytiske forhold som identifikasjon og merking av rør, prøvetaking, prøvebehandling, preanalytiske variabler, utprøving av prøvetakingsutstyr og preanalytisk usikkerhet.
Boken «Blodprøvetaking i praksis» (1) som i 2018 utgis i 3. utgave, er skrevet av lokale bioingeniører. Et doktorgradsprosjekt med tittelen «Estimation of preanalytical uncertainty in clinical chemistry» er gjennomført (2). Det er publisert tre prosedyrer innenfor prøvetaking og identifikasjon ved Helsebiblioteket (3, 4, 5).
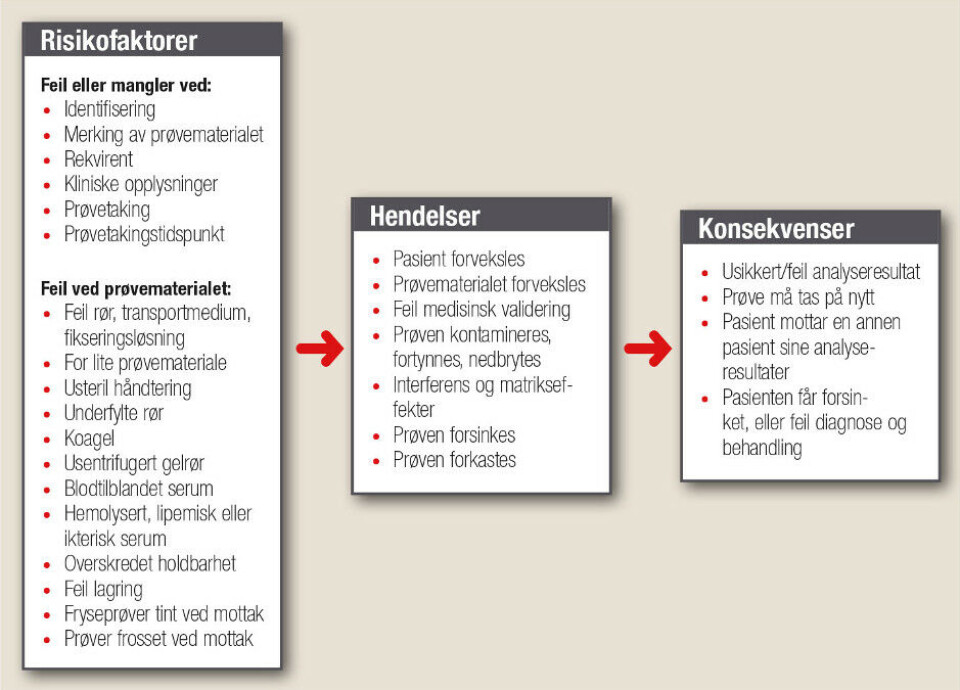
Å etablere kunnskapsbaserte retningslinjer, gjennomføre god opplæring og gi informasjon til prøvetakere og rekvirenter, er nødvendig for å sikre god kvalitet i den preanalytiske fasen. Årlig arrangeres det derfor kurs for helsepersonell i blodprøvetaking og prøvehåndtering, og det undervises om preanalytiske forhold både for studenter ved Høgskulen på Vestlandet og ved Universitet i Bergen. Figur 1 fremstiller flere av de ulike preanalytiske feilene som kan oppstå fra prøven blir bestilt til prøven settes til analyse.
For å sette et enda sterkere fokus på preanalyse har vi opprettet et preanalytisk fagsenter som består av ni bioingeniører og en lege. Den geografiske nærheten mellom de ulike laboratoriene er et godt utgangspunkt for å samle kunnskap og erfaring, bedre samarbeidet og gi preanalyse et viktig fokus og løft på alle laboratoriene. Fagsenteret ønsker å profilere laboratoriemiljøet ved Haukeland universitetssjukehus, og tiltrekke seg både mastergrads- og doktorgradsstudenter.
Denne artikkelen presenterer viktige preanalytiske utfordringer innenfor de ulike fagområdene, og oppsummerer fagsenterets videre planer.
Identifikasjon og merking av prøver
Riktig identifisering av pasient og merking av prøvematerialet er helt avgjørende for pasientsikkerheten. Pasienten skal identifiseres med fullt navn og fødselsnummer. I tillegg skal rekvisisjon og prøvematerialet være merket med rekvirent, dato og tidspunkt for prøvetaking. Medisinske laboratorier mottar ikke sjeldent prøver som mangler tilstrekkelig identifikasjon, noe som gjør at man må be om ny prøve.
Spinalvæske, og enkelte andre prøver til mikrobiologiske- og histologiske undersøkelser, kan være vanskelig å gjenskape, så her må man bruke sunn fornuft. Feilmerkede prøver til blodtyping og forlik før blodtransfusjon kan få fatale følger for pasienten. Derfor tas det alltid to prøver i to uavhengige prøvetakinger før blodtransfusjon.
I Helse Bergen er det innført elektronisk rekvirering av prøver. Det gir raskere analysesvar enn papirrekvisisjon fordi forløpet i prøvemottaket blir kortere. Det gir også lavere risiko for feilmerking av prøver, legekontorene får god oversikt over rekvirerte prøver, og all relevant informasjon er tilgjengelig i pasientjournalen. Elektronisk rekvirering har ført til bedre samhandling mellom legekontor og sykehus.
Kliniske opplysninger sammen med prøvetakingstidspunkt er viktig for at analyseresultatene skal kunne tolkes riktig. For hormonanalyser kan det for eksempel være viktig å vite når i menstruasjonssyklusen og hvilket tidspunkt på døgnet prøven er tatt.
For riktig diagnostisering er det spesielt viktig at prøver som skal til undersøkelser innen mikrobiologi og patologi er merket med type prøvemateriale, prøvetakingssted, prøvetakingstidspunkt, og klinisk mistanke.
Innen medisinsk genetikk er relevant informasjon om pasientens kliniske tilstand nødvendig for å velge riktig analyse. Ofte vil også slektsopplysninger være viktig fordi man leter etter kjent arvelig sykdom eller kreft i familien.
Prøvetaking og prøvehåndtering
Det er viktig å følge gjeldende retningslinjer for prøvetaking og prøvehåndtering.
For å redusere effekten av biologisk variasjon anbefales det generelt fastende blodprøver tatt mellom kl. 07-09 og at pasientene unngår hard fysisk aktivitet tre dager før prøvetakingen.
Flere ulike grupper av helsearbeidere er involvert i prøvetaking, og dette krever god opplæring og gode prosedyrer. Blodprøvetaking på sykehus utføres som oftest av bioingeniører, men i primærhelsetjenesten er det ofte helsesekretærer og sykepleiere som tar blodprøvene. Urinprøver og spyttprøver tas av pasienten selv, mens andre typer materialer som skal til mikrobiologisk undersøkelse tas ofte av lege. Biopsier til histologi og cytologi tas også som regel av lege.
De fleste av analysene som utføres kan søkes opp på www.analyseoversikten.no hvor man kan finne informasjon om prøvetaking, prøvehåndtering, forsendelse m.m.
Laboratoriene har fått en mer effektiv og kvalitetssikker prøvebehandling etter at preanalytisk automasjon ble innført. Premodulene består både av bulkloader, sentrifuger og pipetteringsenheter. Automatisk pipettering gir bedre utnyttelse av prøvematerialet, fordi prøvematerialet pipetteres med bestemt mengde til hver analyse. Siden serum-gelrørene går «på hodet» ned i bulkloaderen så oppdages det nå flere prøver som er blodtilblandet. Dette kan gi lekkasje av komponenter som kalium og LD fra erytrocyttene.
De ulike fagområdene har alle utfordringer med å holde prøvematerialet stabilt.
Stabilitet er avhengig av cellenes metabolisme. Både temperatur, tid, lys, analysemetode og type prøvemateriale påvirker holdbarheten av biokjemiske komponenter. De fleste analytter har god stabilitet ved romtemperatur, men noen trenger kroppstemperatur, og andre bør lagres kaldt eller fryses for å hindre nedbrytning. I tillegg kan komponentene påvirkes av fordamping, ulike kjemiske reaksjoner, kontaminering av prøven, endring i osmotisk trykk eller pH, lyspåvirkning og gassdiffusjon.
Hormonanalyser
Hormoner og deres metabolitter kan være sensitive for nedbrytning, og den preanalytiske behandlingen er helt avgjørende for analyseresultatet. Sensitive hormoner kan stabiliseres ved å fryse ned prøvematerialet, eller tilsette stabilisatorer som hemmer nedbrytningen av peptider og proteiner. Renin og ACTH er eksempler på hormoner der blodprøvene ofte behandles feil, og der begge skal analyseres i EDTA-plasma. Renin skal tas på romtempererte rør og sentrifugeres vanlig, mens ACTH tas på kjølte rør og kjølesentrifugeres. Tidspunkt for prøvetaking er spesielt viktig for komponenter som har døgnvariasjon, eller når aktivitet eller matinntak kan påvirke analyseresultatet. ACTH og kortisol er hormoner med stor døgnvariasjon, mens kjønnshormonene LH, FSH, østradiol og progesteron har syklusvariasjon.
Mikrobiologi
Ved mikrobiologiske undersøkelser som serologi, bakteriologisk dyrkning og molekylærbiologisk diagnostikk, mottas mange ulike typer prøvematerialer som blod, serum, plasma, ulike typer sekret, spinalvæske, urin, feces, leddvæske, vev og aspirat.
Prøver til mikrobiologisk undersøkelse må tas på riktig transportmedium. Feil medium skyldes som oftest at tilnærmet likt prøvetakingsutstyr forveksles, og dermed må prøver forkastes.
Patologi
Ved patologiske undersøkelser er det viktig at prøvematerialet ligger i riktig type fiksativ og med riktig mengdeforhold, og at det ikke brukes for små beholdere slik at vevet blir komprimert.
For histologiske undersøkelser sender primærhelsetjenesten hovedsakelig små preparater som screeningprøver fra livmorhals, små hudbiter og biopsier. Sykehusene sender alt fra store, omfattende operasjonspreparater til små enkle biopsier og aspirat. Det kan være en utfordring å få nok representativt materiale siden prøvetakingen kan være både smertefull og vanskelig. Patologene må være i stand til å identifisere eventuelle morfologiske endringer i vevet og celleendringer, og dette krever god vevskvalitet. Materialet må behandles varsomt for å ivareta vevets morfologi og celledetaljer, samtidig som det raskt må overføres til fikseringsløsning, eller raskt sendes til det aktuelle laboratoriet før forråtnelsesprosessen starter. Fikseringstiden er avhengig av vevsbitens størrelse, tykkelse, vevstype, konsentrasjon og mengde formalin. Ferskt eller ufiksert materiale må fryses ned (frysesnitt). Vev har lett for å feste seg til overflater på beholdere, og bør derfor legges på for eksempel et glatt papir før det legges i en beholder.
Cytologiske undersøkelser utføres både i ascitesvæske, perikardialvæske, pleuravæske, urin, væskebasert cytologi og utstryk på glass. Væskeløsninger fikseres oftest i 70 % etanol. Det er viktig at løsningene blandes godt, men varsomt, slik at alle celler kommer i kontakt med fikseringsløsningen og ikke klumper seg. Væskebasert cytologi har egne beholdere for prøvetaking som inneholder prøvetakingsbørste. Børsten må ristes raskt i løsningen etter prøvetaking, slik at cellene ikke blir sittende fast i børsten. Blodtilblanding bør unngås. Celleutstryk må ikke være for tykke før de sprayfikseres.
Medisinsk genetikk
Ved medisinsk genetiske undersøkelser utføres kromosomanalyser i dyrkede celler fra heparinblod, vevsbiopsier og beinmarg. Kritiske faktorer under prøvetaking og prøvehåndtering er sterile forhold, transporttid og temperatur. Sterile forhold må overholdes for å unngå kontaminering av sopp og bakterier i cellekulturene. Prøvematerialet må transporteres frostfritt helst i romtemperatur, og transporttiden må minimaliseres for å bevare høyest mulig grad av intakte levende celler. For DNA-analyser brukes primært EDTA-blod, men også morkakevev, fostervann, vevsbiopsier og fibroblaster. For RNA-analyser tappes blod eller beinmarg direkte på PAXgene RNA rør som inneholder reagens som stabiliserer intracellulært RNA.
Immunologi og transfusjonsmedisin
En blodgiver må oppfylle bestemte kriterier for å kunne gi blod. Blodproduktene påvirkes i tillegg av posetype, tappeprosedyre og temperatur. For å unngå koagler må blodet blandes godt med antikoagulans. Posene merkes med blodtype, dato, tappenummer og klokkeslett for avsluttet tapping. Etter tapping skal blodet hvile for å få romtemperatur før videre produksjon av blodprodukter. Trombocytter påvirkes av tappetid og blodgivers eventuelle medisinbruk. Det tas BacT/ALERT av alle blodproduktene for å identifisere eventuelle mikroorganismer i blodet. Da er det viktig med steril prøvetaking for å hindre forurensing. De ulike blodproduktene har ulik holdbarhet, og oppbevares ved ulik temperatur.
For immunologiske og flowcytometriske analyser brukes henholdsvis serum og EDTA-blod. Hvis prøven er koagulert vil ikke flowcytometri være mulig. Ved analyse av spinalvæsker og sekret er det viktig å unngå blodtilblanding. Spinalvæsker til immunfenotyping skal fikseres for å unngå degradering av materialet. Prøver fra beinmarg skal tas på heparinisert sprøyte og oppbevares ved romtemperatur.
Transport
Avvikling av postomfordelingen på lørdager har ført til at flere prøver avvises. Spesielt gjelder dette hematologi og koagulasjonsprøver som har kortere holdbarhet enn tre - fire dager. Konsekvensen er at pasienter må innkalles til ny prøvetaking. Ekspressovernatten-transport er en løsning, men dette har betydelige kostnader.
Cirka 160 rekvirenter i vårt distrikt er omfattet av hentetjenesten hvor prøver hentes daglig med bil. Prøvetransportkassene tilfredsstiller krav til emballasje og transport av biologisk materiale, og det bør være en temperatur på mellom 15 og 24 grader under frakt.
Veien videre for fagsenteret
Laboratoriene våre har gode rutiner for å sikre den preanalytiske håndteringen. Fagsenteret ønsker å bidra til at blikket løftes utover den daglige rutinen, og at det igangsettes utviklingsprosjekter og forskning innenfor preanalyse. Det var viktig å få med alle laboratoriefagene for å samarbeide, motivere og lære av hverandre. Vi er nå en stor gruppe som fokuserer på preanalyse. Det at vi kan fungere som et kontaktpunkt for preanalytisk forskning er positivt, og også forpliktende for oss.
Fagsenteret forsetter med det arbeidet som er startet opp og som er beskrevet innledningsvis. Det kan være en utfordring å finne tid siden vi har mange andre arbeidsoppgaver, men målet er at alle medlemmene skal ha et preanalytisk prosjekt som de jobber med eller er involvert i.
Å veilede bachelor- og mastergradsstudenter med oppgaver innenfor preanalyse prioriteres. Vi deltok for eksempel som veiledere for en mastergradsoppgave ved Universitetet i Bergen våren 2017 som hadde tittelen «Påvirkning av fyllingsgrad i K2EDTA-rør på hematologiske parametere».
Per i dag pågår veiledning for følgende tre mastergradsoppgaver:
- Holdbarhet av ulike blodgassparametere.
- Pasientens erfaring ved blodprøvetaking, og etterlevelse av retningslinjer ved prøvetakingen.
- Bestemmelse av intraindividuell biologisk variasjon og referanseområde for ulike allergiparametere.
Et e-læringskurs i prøvetaking er under utarbeiding, og vi arrangerer internundervisning jevnlig med tema innenfor preanalyse, og miniseminarer der ulike mastergradsprosjekter presenteres. Vi er også involvert i et europeisk prosjekt i regi av EFLM (European Federation of Clinical Laboratory Medicine) som hittil har resultert i tre publikasjoner om biologisk variasjon og analytiske kvalitetsspesifikasjoner.
Biobank Haukeland er etablert som et samarbeid mellom Haukeland universitetssykehus og Universitetet i Bergen, og involverer preanalyse i stor grad. Målet er at det etterhvert vil komme noen samarbeidsprosjekter.
Det arrangeres jevnlig både nasjonale og internasjonale kongresser som har preanalyse i fokus, og vi håper at vi får anledning til både å delta og bidra med foredrag.
Takk
Takk til medlemmene av preanalytisk fagsenter som har bidratt til teksten i denne artikkelen.
























