FAG i praksis
Biobanking av vev - en bioingeniøroppgave
Innsamling av ferskt vev til forskningsformål er noe Regional forskningsbiobank Midt-Norge (RFB) har arbeidet med helt siden 2002. For å preservere vevet brukes hurtig nedfrysing etter en protokoll som er utviklet av RFB. I denne artikkelen forklarer vi hvordan vi preserverer prøver fra radikalt operert prostata.
Biobanking av vev - en bioingeniøroppgave.pdf(324 KB)
Et hovedmål med medisinsk forskning er å bidra til bedre diagnostikk og behandling, og i mange forskningsprosjekter utgjør humanbiologisk materiale en nødvendig faktor. Hvis slike prøver samles inn og oppbevares uhensiktsmessig, kan verdien av og kvaliteten på materialet forringes, og analyseresultatene blir upålitelige. I RFB har vi i løpet av en tiårsperiode utviklet en innsamlingsmetode av ferskt vev som viser svært gode resultater med tanke på brukervennlighet og kvalitet.
Begrensende faktorer
Kvaliteten på det humanbiologiske materialet i forskningsbiobanker er avgjørende for hvilke analyser det egner seg til, og den kan påvirke de resultatene man får. Høy materialkvalitet er en premiss for god forskning. Det har vært gjort en del studier på holdbarhet og kvalitet innen biobanking, men svært lite av denne forskningen har vært utført på vev. Vi har derfor lite kunnskap om introduksjon av artefakter og effekt av degradering under ulike preserverings- og lagringsbetingelser. Kunnskap om ulike preanalytiske faktorer er avgjørende for valg av analysemetode, og for å tolke resultatene.
Fiksert vev
Målet med fiksering er å ivareta materialets iboende egenskaper på best mulig måte for de analyser vevet skal brukes til. Fiksering introduserer alltid artefakter, noe som kan føre til at noen analysemetoder er mindre egnet på fiksert materiale. For eksempel degraderes mRNA i vev som er fiksert med formalin og fremført på vanlig måte for histologivurdering. Patologiavdelinger har diagnostiske biobanker som er svært verdifulle på grunn av det store antallet prøver som er innhentet. Å bruke materiale fra de diagnostiske biobankene i forskning, kan tilføre økt kunnskap om årsaker til sykdom og om sykdomsmekanismer, men det forutsetter at vi kjenner virkningen av de preanalytiske faktorene.
Ferskt vev
Dersom man utfører en analyse på vev direkte etter operasjon, er det rimelig å anta at degraderingen er minimal, og at vevets iboende egenskaper har endret seg lite. Av praktiske grunner er det imidlertid mest hensiktsmessig å lagre materialet og vente med å analysere det til man har et visst antall prøver. For å oppnå tilnærmet samme kvalitet på lagret materiale som på det ferske, benyttes i stor utstrekning ultrafrysere på -80 ºC.
Regional forskningsbiobank Midt-Norge (RFB)
RFB bistår forskere som benytter biologisk materiale som samles inn i forbindelse med diagnostikk og behandling, med lagring av helseopplysninger og biologisk materiale (1). I RFB var det per 05.01 2015 registrert 172 578 prøver i 41 ulike studier ved 20 ulike institusjoner, hvorav flere prosjekt er multisenterstudier (figur 1). I tillegg samler RFB rutinemessig inn tumorvev fra prostata, bryst, nyre og hypofyse. Materialet er tilgjengelig for forskere etter søknad til prosjektleder. Målet på lengre sikt er å samle inn vev fra et vidt spekter av operasjonspreparater. RFB arbeider kontinuerlig med metoder for innsamling og oppbevaring av vev av høy kvalitet, samtidig som vi ivaretar hensynet til diagnostikken, og på en måte som sikrer personopplysningsvernet.
Helseforskningslovenes paragraf 32 sier at ”Graden av personidentifikasjon for helseopplysninger skal ikke være større enn nødvendig for å nå målene” (2). Ved bruk av RFBs database ivaretas personopplysningsvernet ved at forskerne ikke har tilgang til verken navn eller fødselsnummer - de forholder seg kun til donornummer, prøvenummer og prøveinformasjon. Serveren befinner seg innenfor helsenettet og driftes av Helse Midt-Norge IT (HEMIT), slik at personopplysninger i biobankens database er underlagt minst like strenge sikkerhetsregler som journalopplysninger.
Ferskfryst vev – en logistisk utfordring
I 2002 utviklet RFB metode og utstyr for hurtig nedfrysing av vev, hvor materiale fra radikalt operert prostata ble brukt som en pilot. Metoden kan benyttes på ulike typer vev, men denne artikkelen bruker beskjæring av prostata som et eksempel for å illustrere fremgangsmåten.
De første årene foregikk selve beskjæringen av prostata inne i operasjonsavdelingen på St. Olavs Hospital, med de utfordringene det ga for renhold og logistikk. Et kritisk punkt ved innsamlingen av vev er tiden det tar fra operasjonen til vevet er fryst. I dag fremstår innsamlingen adskillig mer strømlinjeformet siden preparatet umiddelbart etter operasjon blir sendt med rørpost til Avdeling for patologi og medisinsk genetikk ved St. Olavs Hospital (APMG). Bioingeniører der håndterer all biobanking fra prøvemottak til vevet lagres, og videre behandling av hovedpreparatet som går til diagnostikk. Ansvarlig patolog kontaktes kun dersom det oppstår usikkerhet ved beskjæringen. Det er i tillegg opprettet et satellittlaboratorium i umiddelbar nærhet av operasjonsstuene, og dette fungerer som et kombinert laboratorium for diagnostisk patologi og biobanking av vev.
Uttak av skive fra fersk prostata
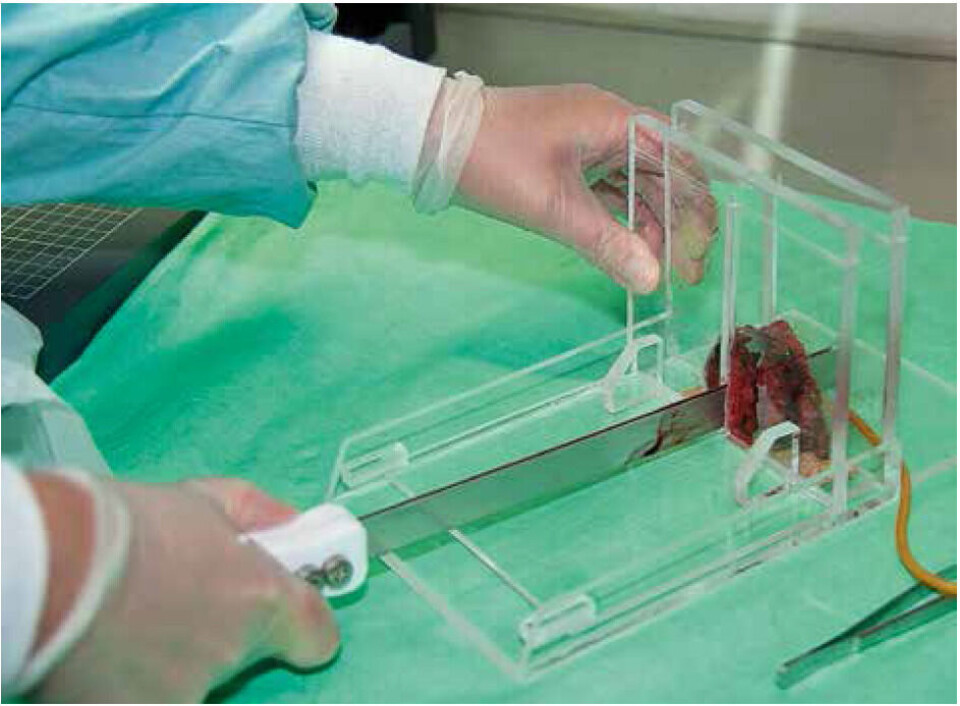
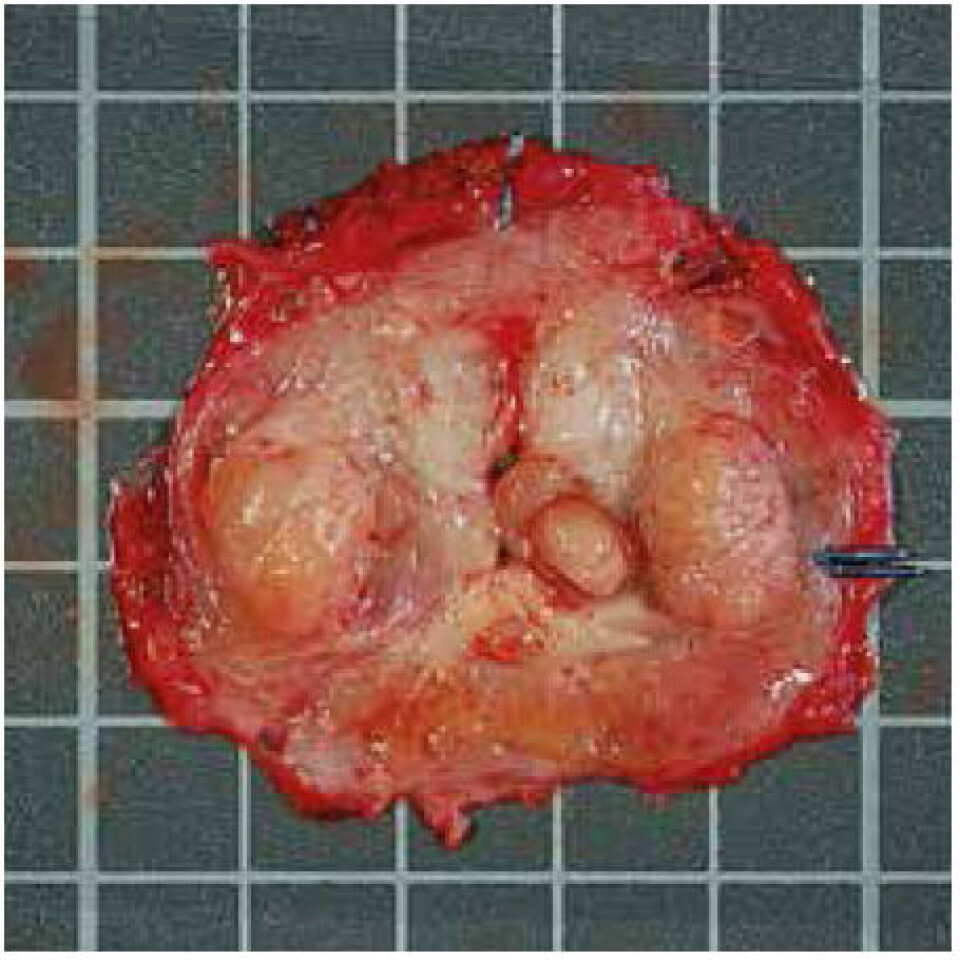
Ved uttak fra radikalt operert prostata tas en 2 mm tykk skive gjennom hele kjertelen på tvers av uretra. Dette gjøres ved å holde fast prostata i et stativ, og benytte en tobladet kniv for å sikre jevn tykkelse (figur 2). Prostataskiven blir deretter fotografert og innregistrert i RFBs database (figur 3). I tillegg til bildet registreres dato, ytterligere opplysninger om materialet og lokalisasjon for lagring. Pasientens fødselsnummer registreres, men blir umiddelbart kryptert og er ikke tilgjengelig for forskerne. Skiven blir så lagt inn i en metallklemme som har vært nedkjølt i flytende nitrogen, for å sikre hurtig innfrysning (”snap freezing”) samt en jevn overflate (figur 4). Den nedfryste skiven blir lagt i en tett plastpose, merket med prøvens løpenummer i strekkodeformat og deretter fraktet til biobanken, hvor den blir lagt i en ultrafryser for oppbevaring ved -80 °C. Restpreparatet legges i formalin og behandles på ordinær måte for diagnostikk. For å unngå at kapselen på prostata trekker seg tilbake under fiksering, legges hver halvdel med snittflaten ned på en isoporplate dekket med et tøystykke, mens kantene festes med synåler før preparatet legges i formalin. Prinsippet ved beskjæring av andre vevstyper er hovedsakelig det samme, men med noen modifikasjoner.
Histologisk korrelering
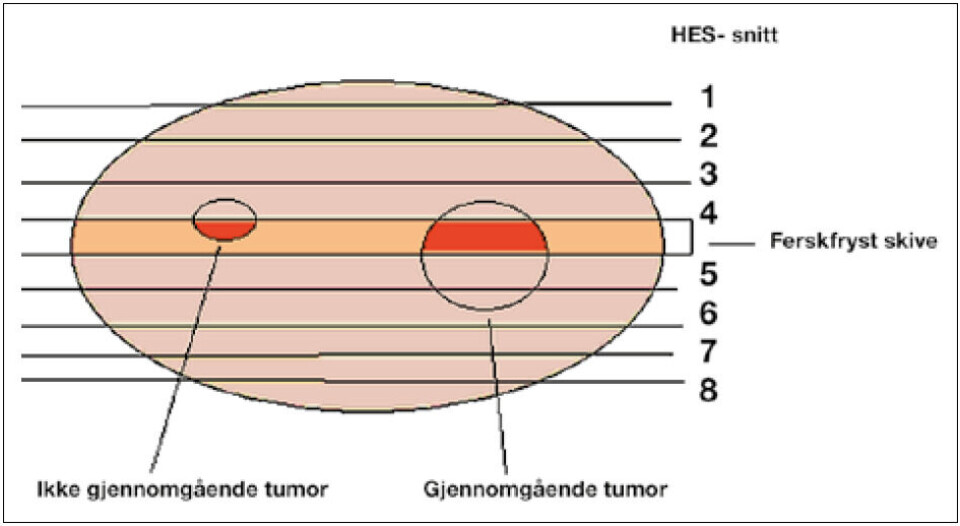
Ved å studere det histologiske restvevet, kan man finne ut hvilke deler av den nedfryste skiven som er mest interessant for forskning. Ved makrobeskjæringen av restvevet noterer man hvor skiven er tatt, dermed kan vevet omkring den fryste skiven studeres, og man finner ut hvor i preparatet de mest interessante funnene er (figur 5). Det er deretter mulig å bore ut en sylinder i den fryste skiven fra det aktuelle området ved hjelp av et hult bor, mens skiven fremdeles holdes dypfryst (figur 6). For å verifisere at uttaket er fra ønsket område, kan det tas et frysesnitt fra sylinderen for å undersøke morfologien. På denne måten kan det histologiske snittet brukes som et kart over den fryste skiven.
Høy kvalitet
Kvaliteten på det ferskfryste vevet er svært høy. Det viser undersøkelser med genekspresjonsanalyser (mikroarrayteknologi eller PCR), samt metabolomikkstudier med MR-spektroskopi (3). Isolering av total-RNA fra 53 sylindre på 3 millimeter ga gjennomsnittlig RIN-skår på 9,16 - noe som indikerer utmerket kvalitet på RNA i det fryste vevet.
Vi har også vist at materialet egner seg til ekstraksjon av proteiner (4), med påfølgende todimensjonal gelelektroforese og MALDI-TOF, og analyse av miRNA med sekvensering.
Å forvalte offentlige ressurser og et så dyrebart materiale fra pasienter som ønsker å gi sitt bidrag til forskningen, forplikter oss. Vi bestreber oss på at innsamlingsmetoden og oppbevaringen er god og sikker, og at vi dermed oppnår meget høy kvalitet på vevet. Materialene og analysemetodene vi bruker i dag er ikke de samme som for ti år siden, og de er neppe de samme som om ti år frem i tid. Derfor er det viktig at innsamlingsmetoden tar høyde for nye teknikker innen småmolekylærbiologi. Man vet ikke om ny teknologi vil stille andre krav, men ved å fryse prøven raskt og å unngå unødig bruk av kjemikalier, øker muligheten for å lykkes.
Pasientsikkerhet
Vev som tas til forskning er ofte fra operasjonspreparater fra kreftsvulster. Pasientene har allerede fått diagnosen kreft og startet behandling. Kirurgisk fjerning av svulsten er et ledd i behandlingen. Preparatet fra operasjonen brukes deretter til å verifisere diagnosen og for å undersøke om man har fått med hele tumoren. Når det tas en skive fra et operasjonspreparat er den største bekymringen at man kan miste muligheten til å se kreftceller i den manglende delen av reseksjonskanten, noe som kan være av prognostisk betydning. Dette er løst ved at man kan hente ut det fryste vevet fra RFB, fiksere og undersøke det mikroskopisk ved den minste mistanke om at det kun er i denne skiva man kan få informasjon om hvorvidt rendene er frie. Av den grunn er det et absolutt krav at man ikke benytter vev i RFB til forskning før svaret fra patologen foreligger. At pasienten får en sikker diagnose har alltid førsteprioritet.
Innsamlingsmetodens styrker
Vev er i sin natur heterogent, noe som representerer en stor utfordring ved bruk i forskning, fordi man ofte ikke har kontroll med den detaljerte strukturen i materialet som undersøkes. Den største fordelen med den beskrevne innsamlingsmetoden er etter vår mening at vi kan korrelere det ferskfryste vevet med det fikserte. Man kan bruke det histologiske snittet som et kart over den fryste skiven, og man kan hente ut mindre vevsprøver fra de områdene som ut fra histologien virker interessante. Ved utvikling av nye analysemetoder kan man undersøke om metoden kan overføres fra ferskfryst til fiksert vev, og samtidig finne ut om dette medfører systematiske endringer i analyseresultatet.
Samarbeid mellom RFB og APMG
Å beskjære vev, registrere prøver, håndtere utstyr og frakte prøver, tar tid. Tid man ikke alltid kan avse i en travel arbeidshverdag ved en patologiavdeling med stadig økende prøvemengde for hvert år. I Trondheim går derfor RFB inn med lønnsmidler for å kompensere for tidsbruken. Samarbeidet mellom RFB og APMG har fungert utmerket siden oppstart, og bioingeniørene der har fått et mer variert og spennende arbeid ved å gi et verdifullt bidrag til forskning. Resultater fra kvalitetsanalyser i RFB kan gi økt kunnskap om preanalytiske faktorer for viktige analytter, noe som kan implementeres i rutinebehandlingen av vev.
Veien videre
Fremover planlegges flere kvalitetsstudier, blant annet på lipider. Umettede lipider er utsatt for oksidering, og antas å være blant de markørene som er mest sårbare i vev. Det er dermed en god analytt for å monitorere vevets holdbarhet og kvalitet ved langtidslagring. Etablering av nye metoder for å sammenligne ferskfryst og fiksert vev vil fortsette også i fremtiden. Å se på alternative metoder for lagring av vev er et annet aktuelt tema, for eksempel frysetørking av vev (5).
Biobank Norge er et konsortium av alle de store biobankaktørene i Norge og er nå i en prosess for å etablere en nasjonal kreftbiobank. Mye tyder på at RFBs metode for innhenting av vev til biobanking skal prøves ut i denne sammenheng.
Bioingeniører har gode kunnskaper om preanalytiske og analytiske faktorer. De som jobber i patologilaboratorier har i tillegg førstehånds kunnskap om behandling av vev.
Det er derfor av stor betydning at bioingeniører deltar i utviklingen av biobankene.
Takk
Takk til alle gode medarbeidere og ledelse ved APMG og ansatte ved Urologisk klinikk ved St. Olavs Hospital HF for omfattende og utmerket samarbeid.