FAG i praksis
Nye blodtypeantigener, nye systemer og ny nomenklatur
Det begynte med ABO. I 1901 oppdaget den østerrikske vitenskapsmannen Karl Landsteiner blodtypesystemet ABO. Lenge var det bare ABO, men de siste årene har jeg nesten hver gang jeg har holdt foredrag om blodtypesystemer, måttet oppdatere tallet på kjente blodtypesystemer og -antigener.
Nye blodtypeantigener, nye systemer og ny nomenklatur.pdf(253 KB)
Selv om det gikk mange år fra oppdagelsen av ABO-systemet til de neste systemene ble identifisert, har utviklingen de siste årene vært nesten eksplosiv. Og det er ikke bare antallet som øker, men også den kunnskapsbaserte forståelsen om blodtypesystemene og -antigenene.
Hvorfor er blodtypesystemene viktige?
Uforlikelighet mellom pasient og donor eller mellom mor og foster/barn, kan ha store konsekvenser ved henholdsvis transfusjon, transplantasjon og svangerskap. ABO-antigener uttrykkes ikke bare på erytrocytter, men også på leukocytter, trombocytter og endotel- og epitelceller (blod- og vevstypeantigener). Vanligvis unngår man ABO-uforlikelige organtransplantasjoner, men ved hjelp av nye immunsuppressive medikamenter og teknikker som effektivt fjerner anti-A og/eller anti-B, både i forkant og etter transplantasjon, har man utført mange vellykkede ABO-uforlikelige nyretransplantasjoner (1).
ABO-antigener uttrykkes ikke på hematopoetiske stamceller, derfor er stamcelletransplantasjoner ikke kontraindisert ved ABO-uforlikelighet. Imidlertid kan det oppstå hemolyse spesielt på grunn av høytitrede antistoffer (anti-A og -B) hos mottaker og/eller donor (2). For å hindre hemolysen bør det settes i gang tiltak som fjerner de høytitrede antistoffene ved slike transplantasjoner.
Klinisk betydning
De fleste blodtypesystemene ble funnet fordi antistoff-antigen-reaksjoner har ført til enten hemolytiske transfusjonsreaksjoner (HTR) eller hemolytisk sykdom hos foster og nyfødt (HSFN). I dag kjenner vi flere antistoffer som ikke har klinisk betydning, det vil si at de verken forårsaker HTR eller har konsekvenser i svangerskapet.
HTR kan i verste fall være fatal (akutt HTR), eller ha et mildere forløp (forsinket HTR). HSFN kan også forløpe fra mild til alvorlig og enkelte ganger fatal. Det dannes såkalt naturlig forekommende antistoffer mot det ABO-blodtypeantigenet individet mangler; for eksempel har et individ med blodtype A, anti-B i sitt plasma. Dette kalles Landsteiners lov. Disse antistoffene er stort sett IgM-antistoffer som kan føre til HTR ved uforlikelighet. Det er imidlertid kun IgG-antistoffer som kan passere over til fosteret via morkaken og forårsake HSFN.
Hva er et blodtypeantigen - og et blodtypesystem?
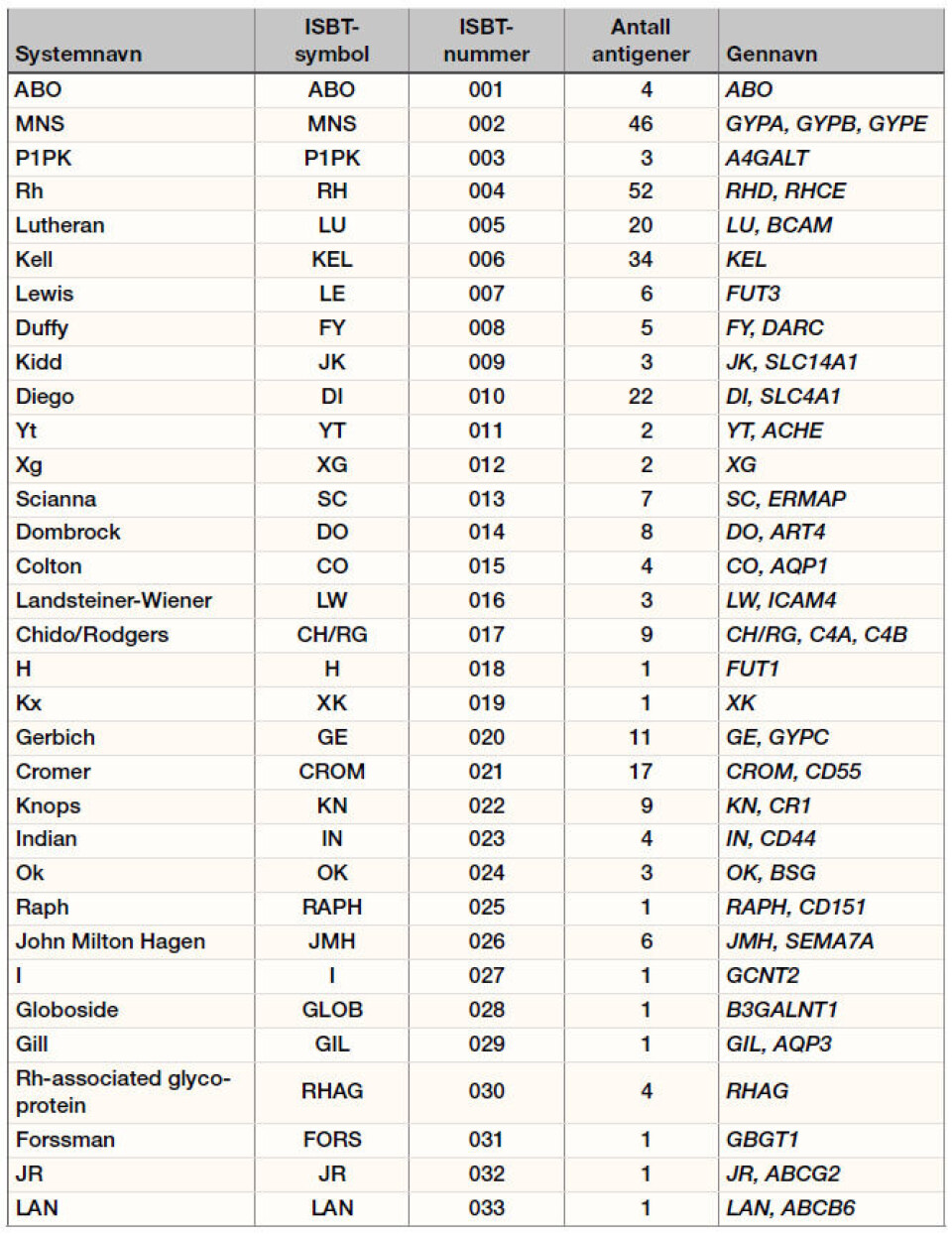
Hvert blodtypesystem har fra ett (H, Kx, Raph, I, Globoside, Gill, Forssman, JR og LAN) til 52 (Rh-systemet) antigener (3). Rh-systemet er det mest polymorfe, etterfulgt av MNS-systemet med sine 46 antigener. De 33 blodtypesystemene er lokalisert på 15 forskjellige kromosomer, for eksempel ABO-systemet på kromosom 9, Rh-systemet på kromosom 1 og Xga på X-kromosomet.
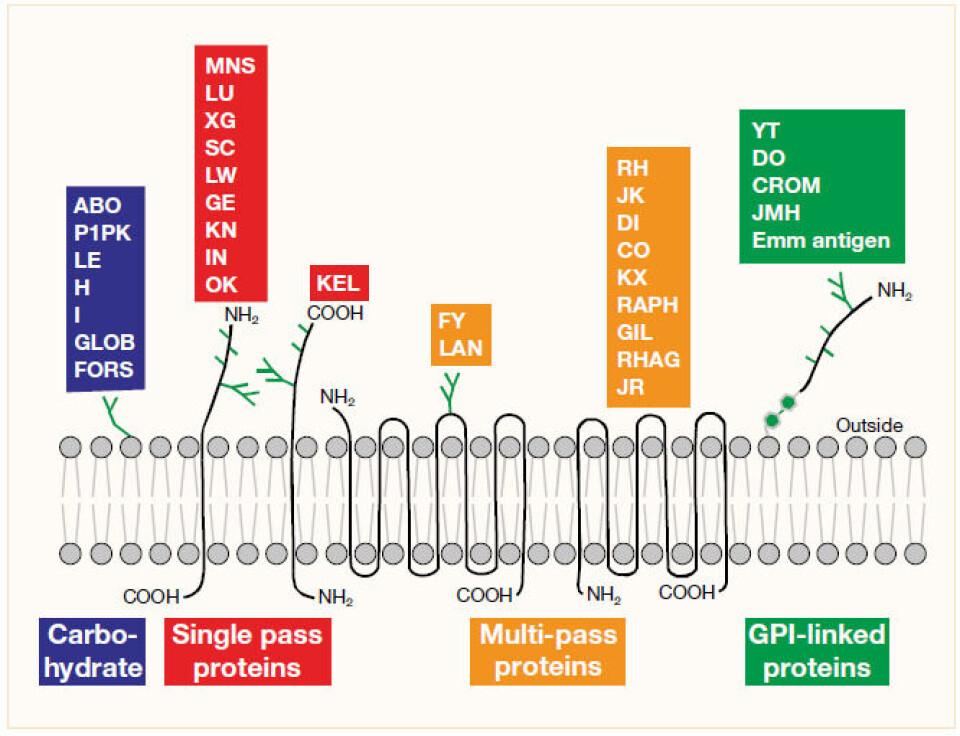
Blodtypeantigenene er membranstrukturer på erytrocyttene. Et dobbelt lipidlag bygger membranen sammen med proteinmolekyler, karbohydrater og fosfolipider (4). Mens enkelte antigener går gjennom membranen én eller flere ganger, er andre ankret på selve membranen, som oftest via en lipidhale eller festet på proteiner (se figur 1).
I den første gruppen som passerer membranen én gang, finner vi KEL, MNS, LU, XG, SC, LW, GE, KN, IN og OK.
RH, JK, DI, CO, KX, RAPH, GIL, RHAG, JR, FY og LAN passerer membranen flere ganger.
ABO, P1PK, LE, H, I, GLOB og FORS hører til den siste gruppen (karbohydratantigener) som er bundet til proteiner eller lipider på membranen (3).
Det finnes enda to grupper basert på hvilken type membrankomponent som bærer blodtypeantigenene:
- Glykosyl-fosfatidylinositol (GPI)-linket protein (YT, DO, CROM og JMH)
- Antigener som bæres på komplementfaktor 4d (C4d) og adsorberes fra plasma over til erytrocyttmembran (CH/RG) (5).
Flere antigener uttrykkes også i andre vev enn på erytrocytter, for eksempel ABO, P1PK, H, Lewis og Globoside (6).
Blodtypeantigener oppstår på grunn av genetiske polymorfismer, og arves fra begge foreldrene. For at et antigen skal kvalifisere seg til å danne et blodtypesystem, må det spesifikke antigenet først og fremst identifiseres med et humant alloantistoff. Antigenet må også være nedarvet og genet som koder for antigenet må være kartlagt, sekvensert og kromosomtilhørigheten må være bestemt (7).
Vi kan dele blodtypeantigener i følgende hovedgrupper (7):
- Blodtypesystemer: Ett eller flere antigener som kodes av ett enkelt gen, eller to eller flere, som er nært knyttet homologe gener med liten eller ingen rekombinasjon (overkrysning). Eksempler er ABO- og Rh-systemene.
- ISBT blodtypesamlinger (ISBT = International Society of Blood Transfusion): Antigenene i disse samlingene har serologiske, biokjemiske og genetiske felles trekk, men oppfyller ikke kriteriene for å danne blodtypesystemer. Eksempler er Cost- og Vel-blodtypesamlingene.
- ISBT 700-serien med lavfrekvente antigener: Færre enn én prosent av mennesker har disse antigenene som ikke kan klassifiseres inn under noe blodtypesystem. Eksempler er Batty (By)- og Christiansen (Chra)-antigenene.
- ISBT 901-serien med høyfrekvente antigener finnes hos mer enn 90 prosent av oss mennesker. Vi kjenner ikke per dags dato hvilke gener som koder for disse antigenene. De faller derfor ikke under blodtypesystemer eller blodtypesamlinger. Eksempler er August (ATa) og Sid (Sda)-antigenene.
Fem funksjonskategorier
Det internasjonale fagtidsskriftet Transfusion hadde 50-årsjubileum i 2010. Da den første utgaven av Transfusion kom på trykk i 1961, var knappe halvparten av blodtypesystemene vi kjenner i dag oppdaget. I artikkelen som Geoff Daniels og Marion Reid skrev i Transfusion i forbindelse med jubileumsåret, rapporterte de 30 blodtypesystemer og 270 blodtypeantigener som hører til systemene (5). I tillegg var det 38 antigener utenom de kjente blodtypesystemene, altså totalt 308 antigener i 2010. I løpet av de neste tre årene har tallene kommet opp i henholdsvis 33, 297 og 339 (8). Selv om ny kunnskap, og ikke minst molekylærbiologiske metoder, har sørget for bedre forståelse av struktur og gener som koder for blodtypeantigenene, har vi fremdeles noe begrenset kjennskap til funksjonen. Trolig hadde enkelte antigener funksjoner tidligere i evolusjonen, men ikke nå lenger. Andre kan fremdeles ha en funksjon i erytropoesen, men ikke etter at erytrocyttene kommer ut i blodbanen (9). Likevel kan vi dele de fleste blodtypeantigenene i fem funksjonskategorier (10):
- Membrantransportører og kanaler.
- Adhesjonsmolekyler.
- Reseptorer for eksterne patogener som virus, bakterier og parasitter.
- Enzymer.
- Strukturelle proteiner.
Null-fenotyper
De fleste blodtypesystemer har null-fenotyper, det vil si at ingen av systemets antigener er uttrykt på erytrocyttene. Null-fenotyper skyldes oftest at man er homozygot for inaktiverende mutasjoner. Dette forekommer sjeldent og er vanligvis ikke assosiert med sykdom (5). Likevel er Rh-null, for eksempel, assosiert med en viss grad av hemolytisk anemi. Grunnen er redusert overlevelse av individets egne erytrocytter som er blitt til skjøre stomatocytter (erytrocytter med avlangt blekt område som ligner på en munn) og sferocytter (erytrocytter som har mistet diskoidformen og blitt mindre og runde).
Nomenklatur eller kaos?
Historisk sett har blodtypesystemer og antigener vært oppkalt etter enten pasienten antigenet/antistoffet ble påvist hos første gang, eller den/de som har oppdaget dem. Terminologien har vært svært forvirrende og ikke konsekvent; samme antigen kan også ha fått forskjellige betegnelser. Både bokstaver og tall; romerske som arabiske, er benyttet. International Society of Blood Transfusion (ISBT) har derfor, for å få en slutt på ”galskapen”, slik Daniels & Reid uttrykker det (5), etablert en egen arbeidsgruppe som har jobbet med terminologien. Arbeidsgruppen har publisert sine verker siden 1982 (7) og foreslått felles nomenklatur (se tabell 1). Siden det i tillegg til blodtypesystemer finnes samlinger og serier av antigener som ikke hører til noe blodtypesystem, er arbeidet utfordrende. Noen antigener, inkludert hovedsystemet ABO, nevnes med enkle bokstaver; som A, B og O. Alleliske antigener uttrykkes enten med en liten bokstav og hevet eller senket skrift; for eksempel Jka og Jkb. En del andre antigener suppleres med tall, for eksempel Fy3. Mange systemer har også fått Cluster of differentiation (CD)-nummer; for eksempel CD235 for MNS-systemet.
ISBT-terminologien
Hvert antigen som hører til et blodtypesystem identifiseres med et sekssifret nummer; de tre første sifrene representerer selve systemet og resten spesifisiteten. ABO-systemet var det første som ble oppdaget, ISBT-nummer er dermed 001 og ISBT-symbolet ABO. Det heter O (bokstaven) og ikke 0 (tallet). MNS-systemet var det andre systemet som ble oppdaget og ISBT-nummer og symbol er henholdsvis 002 og MNS. Rh-systemet har nummer 004 og symbol RH, Kell-systemet har 006 og KEL osv. Også antigenene er nummerert etter når de ble oppdaget. K-antigenet fra Kell-systemet var det første som ble oppdaget i dette systemet, ISBT-nummeret for dette antigenet er derfor 006001 (3). Tall-terminologien er primært laget for komputerdatabaser. Å bruke disse tallene i blodbankhverdagen kan føre til alvorlige misforståelser, derfor er den tradisjonelle nomenklaturen å foretrekke i den sammenhengen.
Hvis et blodtypeantigen er påvist serologisk, betegnes det aktuelle genet med ISBT-symbol, etterfulgt av en stjerne og deretter antigennummeret, alt i kursiv; for eksempel JK*02 for Jkb.
Tidligere svak D og partiell D skal nå hete variant D
Ettersom svak D har vært betraktet kun som et kvantitativt fenomen med alle epitopene tilstede, dog svakere, trodde man at individer med svak D ikke kunne danne anti-D. Partiell D derimot, som mangler en del epitoper, var antatt å kunne danne anti-D. Derfor har det vært anbefalt å transfundere pasienter med svak D med D positivt blod og pasienter med partiell D med D negativt blod. Etter hvert kunne man påvise mange typer svake D-er (fra svak D type 1 til type 73). Man så at pasienter med enkelte typer svak D likevel ble immunisert og dannet anti-D. I de senere årene er det også påvist at svake D-er har flere kvalitative forskjeller, ikke bare kvantitative, slik at forskjellen mellom svak og partiell D ikke lenger er absolutt. Derfor oppfordres fagmiljøet til å ta i bruk «variant D» som et samlebegrep (5).
De aller nyeste blodtypesystemene
RHAG (ISBT nummer 030)
Vår avdeling bidro til oppdagelsen av dette 30. blodtypesystemet. Rh-assosiert glykoprotein (RHAG-systemet) ble funnet i samarbeid med forskere fra Storbritannia og Japan (11). Det er to høyfrekvente (Duclos og DSLK) og to lavfrekvente (Ola og RHAG4) antigener i RHAG-systemet. Ola er påvist hos en norsk familie og er assosiert med svekket ekspresjon av Rh-antigenene D, C og E. RHAG er et glykoprotein som passerer cellemembranen flere ganger. Sammen med RhD og/eller RhCE danner RHAG et kompleks som sørger for erytrocyttmembranintegriteten.
FORS (ISBT nummer 031)
Dette systemet er også et blod- og vevstypesystem, og har kun et lavfrekvent antigen; FORS1 (Forssman-antigen) som normalt ikke uttrykkes på blodceller. Først trodde man at antigenet var en subgruppe av ABO-systemets A-antigen. I 2011 kunne man påvise at antigenet likevel var uavhengig av ABO (6). FORS1-uttrykk på humane celler kan muligens øke mottagelighet for E. coli-infeksjoner (3). Det er også vist at Forssman-glykolipid uttrykkes ved noen krefttyper som lunge-, tykktarms- og magesekkreft. Det er ikke kjent om antistoff mot FORS1 har klinisk betydning.
JR (ISBT nummer 032)
Jra-antigenet ble regnet som et høyfrekvent antigen i 901-serien inntil 2012, men da påviste Zelinski et al. (12) at ATP-bindende kassett (ABC) ABCG2-null-alleler definerer Jra-null-fenotypen (5). Jra-negativ-fenotype er funnet hos japanere og andre asiater, i tillegg til nordeuropeere, beduiner og ett tilfelle i Mexico (13). Jra-glykoproteinet går gjennom erytrocyttmembranen seks ganger. Over 99 prosent av alle folkegrupper har Jra, derfor er det vanskelig å skaffe antigen-negativt blod til pasienter med anti-Jra-antistoff. Anti-Jra er av klinisk betydning siden det kan føre til både hemolytiske transfusjonsreaksjoner og HSFN (13). Pasienter med anti-Jra bør, så lenge de helsemessig er i stand til det, oppfordres til autolog donasjon med tanke på fryselagring. Jra er involvert i cellegiftresistens i kreftcellene, og spesielt ved brystkreft. Når Jra er uttrykt over normalt nivå, blir cellene resistente mot enkelte typer cellegift.
LAN (ISBT nummer 033)
LAN (Langereis) har også vært regnet blant de høyfrekvente antigenene, men i 2012 ble det vist at ABC-membrantransportøren ABCB6 bærer Lan-antigenet på erytrocyttene. ABCB6 koder for Lan-systemet. Individer med null-fenotypen (ABCB6-/-) utvikler ingen sykdom, men kan risikere eventuell resistens mot cellegift; jo høyere ABCB6-uttrykk, jo større risiko for multimedikamentresistens (14). Anti-Lan er som regel IgG, og fra mild til alvorlig HTR og HSFN er beskrevet (14, 15). Anbefalingen om autolog tapping gjelder også pasienter med anti-Lan.
Metoder
Valg av utredningsmetode i transfusjonsmedisin er avgjørende for å kunne detektere klinisk viktige antistoffer, men også av hensyn til fornuftig ressursbruk. Hovedsakelig er det to grunnleggende metoder som brukes; serologi og molekylærbiologi. Den mest brukte metoden ved blodtypeserologiske utredninger har vært hemagglutinasjon. Ved hjelp av enzymbehandling av cellene eller tilsetning av antiglobulinreagens eller polyetylenglykol (PEG), kan man forsterke reaksjonene, øke følsomheten og detektere svake antistoffer. Indirekte antiglobulintest egner seg best til å detektere IgG-antistoffer. Introduksjon av monoklonale antistoffer mot blodtypeantigener har endret og forenklet blodbankhverdagen betydelig. Nå kan man detektere antigener med få epitoper ved direkte hemaglutinasjon, noe som ellers ville krevd indirekte antiglobulinteknikk.
Molekylærbiologiske metoder har åpnet en ny æra og fått stadig mer plass innen transfusjonsmedisin/immunhematologi. De har ikke minst bidratt til økt forståelse for flere blodtypesystemer. Metoden er robust og gir mye informasjon og klare svar. Ved hjelp av high-throughput teknologi kan man analysere mange blodtypesystemer/antigener samtidig. Pasienter som har dannet multiple blodtypeantistoffer kan være en utfordring med hensyn til å skaffe forlikelig blod. Utvidet genotyping av blodgiverkorpset på mange blodtypesystemer vil gjøre det enklere å finne antigen-negative blodenheter til denne pasientgruppen. Dette er noe vi er i gang med ved Avdeling for immunologi og transfusjonsmedisin, Oslo universitetssykehus. Implementering av dette vil forkorte tiden vi trenger for å skaffe forlikelig blod til disse pasientene når det virkelig haster.
Konklusjon og noen tanker om fremtiden
Inntil ISBT kom på banen på 80-tallet, var ikke blodtypesystemterminologien systematisk. Tradisjonelt har både tall og bokstaver vært brukt om hverandre, og ikke minst forkortelser som refererer til enten oppdageren eller pasienten antigenet/antistoffet er påvist hos. Selv om det ikke er praktisk å bruke ISBT-terminologien i det daglige, sørger den for en gjennomgripende orden i kaoset. For ikke å bidra til forvirringen, kan vi for vår del starte med å bruke kun Rh og ikke ”Rhesus” for Rh-systemet, siden ”Rhesus” hører til apekattenes verden og ikke til menneskenes.
Den eksplosive utviklingen i antallet blodtypeantigener og -systemer, vil neppe fortsette. Men det er naturlig å tro at kunnskapen om blodtypeantigenenes funksjon og betydning, samt forståelsen for hvordan alle systemene henger sammen, vil bli mye bedre i årene som kommer.