FAG i praksis
HPV-deteksjon som en tilleggsundersøkelse til cytologiscreening ved usikre og lavgradige celleforandringer
Ifølge flytskjema for HPV-testing har det siden 2005 vært anbefalt å gjøre HPV-testing som en tilleggsundersøkelse på kvinner som deltar i den norske masseundersøkelsen mot livmorhalskreft. Det finnes i dag en rekke forskjellige kommersielt tilgjengelige HPV-tester. Noen av disse har vært på markedet i mange år og er godt utprøvd i store studier, mens andre er utviklet de siste to - tre årene. Metodene varierer med hensyn til hvorvidt de påviser mRNA eller DNA fra høyrisiko Humant Papilloma Virus (hrHPV), og hvilke hrHPV genotyper de påviser. Det har vært hevdet at mRNA-tester er mer spesifikke enn DNA-tester, fordi de påviser en aktiv infeksjon med proteinsyntese av de onkogene proteinene E6 og E7. Ved Stavanger Universitetssjukehus er det gjort en sammenligning av forskjellige HPV-metoder.
Bakgrunn
For atypisk skvammøs celleforandring av usikker betydning (ASCUS) og lavgradig skvammøs lesjon (LSIL) kan forskjeller i fortolkning og lav sensitivitet være problematisk (2, 3). For disse cytologidiagnosene er påvisning av Humant Papilloma Virus (HPV) derfor brukt i utstrakt grad, siden en persistent infeksjon med hrHPV er nødvendig for å utvikle cervical intraepitelial neoplasia (CIN), dvs. forstadium til livmorhalskreft (4, 5).
For kvinner med cytologidiagnose ASCUS eller LSIL blir det anbefalt å ta en oppfølgende cytologiprøve etter 6-12 måneder. Ifølge flytskjema utarbeidet på bakgrunn av anbefalinger fra ”Faglig Rådgivningsgruppe for Masseundersøkelsen mot livmorhalskreft” i Norge, skal denne oppfølgende prøven diagnostiseres med cytologi og analyseres for tilstedeværelse av hrHPV.
Dersom oppfølgingscytologien fremdeles viser ASCUS, LSIL eller HSIL (høygradig skvammøs lesjon) og/eller at HPV-testen er positiv, vil det bli anbefalt at kvinnene tar en biopsi for å bekrefte eller avkrefte om de har høygradige celleforandringer (CIN2-3) som kan utvikle seg til livmorhalskreft.
Dersom biopsien bekrefter at det er en CIN2-3, blir det anbefalt at kvinnene behandles med konisering, det vil si kirurgisk fjerning av den delen av livmorhalsen som har celleforandringer. Dette medfører overbehandling av 15-40 % av kvinnene med CIN2-3 forstadier, fordi disse ville forsvunnet spontant uten behandling.
Immunologiske og epiteliale cellefaktorer hos kvinnene, i tillegg til virusegenskaper, har betydning for spontan regresjon av en lesjon (6, 7).
Materiale
Studien er godkjent av REK vest, Norge (2010/2550).
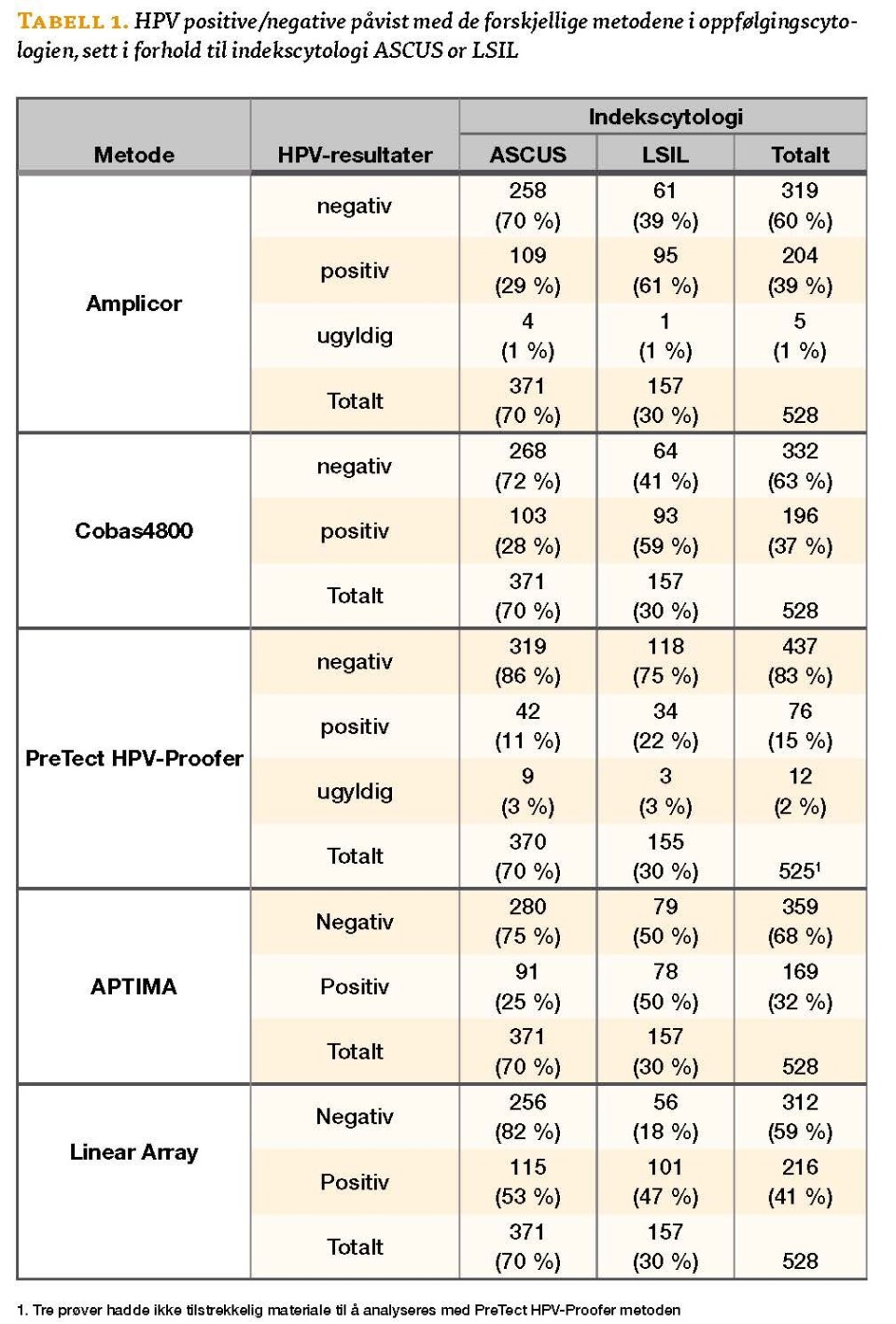
På Avdeling for patologi, Stavanger universitetssjukehus, ble det nylig gjort en sammenligning av forskjellige HPV-tester. Prøvematerialet var ThinPrep® væskebasert cytologisk materiale (Preservecyt TM, Marlborough, MA, USA) fra 528 kvinner som deltar i den norske masseundersøkelsen mot livmorhalskreft og som opprinnelig hadde cytologidiagnose (indekscytologi) ASCUS/LSIL.
Ifølge retningslinjene ble det tatt en ny cytologiprøve 6-12 måneder etter indekscytologi. Denne ble hrHPV-testet og brukt i sammenligningen. Prøvene ble samlet inn fra januar til juni i 2010.
Metoder
De forskjellige HPV-metodene som ble brukt i sammenligningen var:
- Amplicor HPV DNA-test påviser 13 hrHPV virus (16, 18, 31, 33 35, 39, 45, 51, 52, 56, 58, 59 og 68).
- Linear Array genotyping test påviser spesifikt DNA fra 37 forskjellige HPV genotyper, (6, 11, 16, 18, 26, 31, 33, 35, 39, 40, 42, 45, 51, 52, 53, 54, 55, 56, 58, 59, 61, 62, 64, 66, 67, 68, 69, 70, 71, 72, 73, 81, 82, 83, 84, 89 og IS39 (subtype av 82)), 12 høyrisiko, en sannsynlig høyrisiko, 7 mulig høyrisiko, 8 lavrisiko og 9 ikke klassifiserte.
- Cobas4800 er fullautomatisert og påviser HPV DNA fra 14 hrHPV, (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 og 68), i tillegg til separat genotyping av HPV 16 og 18. Amplicor, Linear Array og Cobas4800 (Roche Molecular systems, Roche Diagnostics GmbH, Mannheim, Tyskland) påviser β-globin i hver prøve som intern kontroll på adekvat prøvemateriale.
- PreTect HPV-Proofer (Proofer) (NorChip AS, Klokkarstua, Oslo, Norge) påviser E6/E7 full-lengde mRNA fra 5 hrHPV virustyper (16, 18, 31, 33 og 45), i tillegg til mRNA fra U1A i hver prøve som intern kontroll på adekvat prøvemateriale.
- APTIMA (Gen-Probe, San Diego, CA, USA) er basert på isolering og amplifisering av E6/E7 mRNA fra 14 hrHPV typer (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 og 68) i ett og samme rør.
Alle metodene ble utført i henhold til produsentenes anbefalinger og analyttisk positiv og negativ kontroll var med i hvert prøveoppsett for alle metodene.
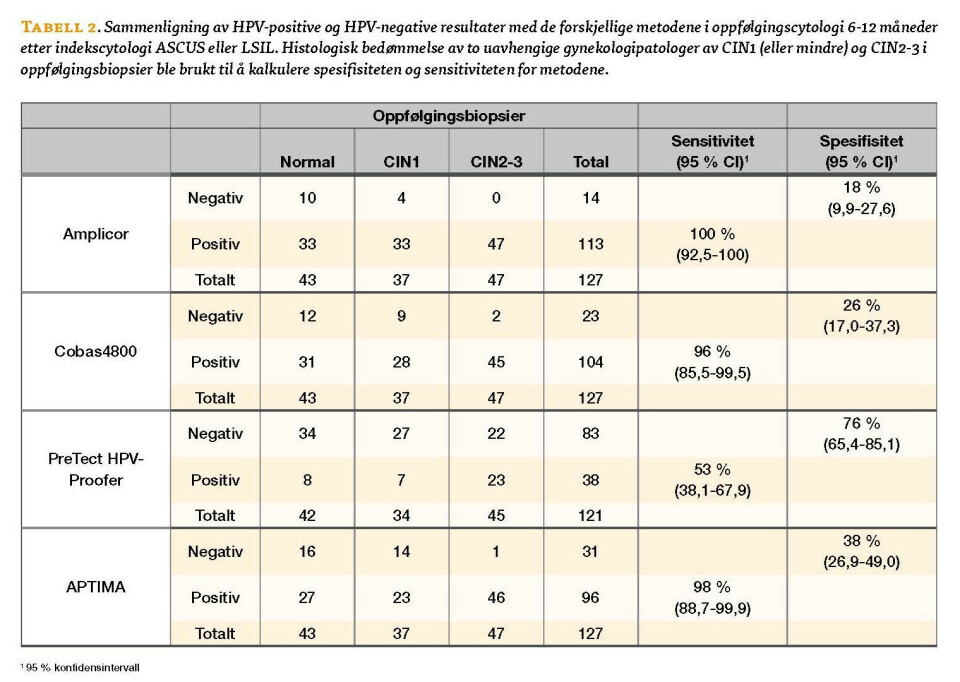
Resultat fra Amplicor HPV-test sammen med cytologisk diagnose avgjorde om det ble anbefalt å ta en oppfølgingsbiopsi. De forskjellige metodenes evne til å påvise HPV i væskebaserte cytologiprøver ble undersøkt, i tillegg til deres sensitivitet for å påvise CIN2-3 og spesifisitet for å påvise CIN1 eller mindre i oppfølgingsbiopsien. Det ble også undersøkt om de forskjellige metodene hadde evne til å forutsi spontan regresjon av CIN2-3. Ved siste oppdatering i desember 2010 var det 47 med biopsidiagnose CIN2-3 og 35 av disse var konisert, (gjennomsnittlig tidsintervall 10 uker). 12 (32 %) viste spontan regresjon, definert som CIN1 eller mindre i oppfølgingskonisat. Linear Array ble brukt til å sammenligne resultat av delvis genotyping med Cobas4800 og Proofer.
Resultater
Som vist i Tabell 1 var antallet HPV-positive prøver relativt likt for Amplicor og Cobas4800, (204/528 = 39 % og 196/528 = 37 %), for APTIMA var antallet bare litt lavere (169/528=32 %). Proofer hadde lavest antall HPV-positive (76/513=15 %). Sammenlignet med Linear Array, var overensstemmelsen 90 % for genotyping av HPV 16 og 18 med Cobas4800 og 70 % for genotyping av HPV 16, 18, 31, 33 og 45 med Proofer.
Sammenligning av kappaverdier viser nesten perfekt overensstemmelsen mellom Amplicor og Cobas4800 (κ = 0,85). Amplicor og Proofer har mindre bra overensstemmelse (κ = 0,33). Amplicor og APTIMA har betydelig overensstemmelse (κ = 0,74). Cobas4800 og Proofer har mindre bra overensstemmelse (κ = 0,34), mens Cobas4800 og APTIMA har nesten perfekt overensstemmelse, (κ = 0,81). Proofer og APTIMA har moderat overensstemmelse (κ = 0,41).
Sensitiviteten for å påvise CIN2-3 i oppfølgingsbiopsier (95 % konfidensintervall) var svært høy for Amplicor, Cobas4800 og APTIMA: henholdsvis 100 % (92,5-100), 96 % (85,5-99,5) og 98 % (88,7-99,9), og lavest for Proofer 53 % (38,1-67,9). Spesifisiteten for å påvise CIN1 eller mindre var lav for Amplicor og Cobas4800: henholdsvis 18 % (9,9-27,6) og 26 % (17,0-37,3), noe høyere for APTIMA: 38 % (26.9-49.0), mens Proofer hadde den høyeste spesifisiteten: 76 % (65,4-85,1), (se Tabell 2).
Ingen av metodene hadde evne til å forutsi spontan regresjon av CIN2-3.
Diskusjon
Påvisning av hrHPV og sensitiviteten for å forutsi CIN2-3 med Amplicor, Cobas4800 og APTIMA viser nesten perfekt samsvar, mens Proofer er signifikant forskjellig fra de andre testene med betraktelig lavere antall HPV-positive og lavere sensitivitet. Resultatene i denne sammenligningen viser at mRNA-testene har høyere spesifisitet enn DNA-testene. Sammenlignet med APTIMA kan det synes som en høy spesifisitet for PreTect HPV- Proofer skjer på bekostning av lavere klinisk sensitivitet.
Overensstemmelsen mellom de to mRNA-baserte testene, Proofer og APTIMA, er moderat, (kappa=0,41), med 22 % uoverensstemmelse. Det er tekniske forskjeller mellom de to metodene, siden Proofer bare påviser 5 og APTIMA 14 hrHPV subtyper. Vi fant at 27 % av CIN2-3-lesjonene som ikke ble påvist med Proofer, inneholdt virus som testen ikke kunne påvise. Den lave kliniske sensitiviteten for Proofer i vår studie blir bekreftet i andre studier (8).
Før påvisning av hrHPV ble inkludert i masseundersøkelsen mot livmorhalskreft, var den vanlige prosedyren å gjenta cytologiscreening av kvinner med ASCUS/LSIL-diagnose. Dette førte til at disse kvinnene hadde en uavklart diagnose og gjentatte cytologiske prøver før biopsering. Siden 2005 har HPV blitt brukt i triage av ASCUS/LSIL, det vil si at en sorterer disse i HPV-negative og HPV-positive kasus som avgjør den videre oppfølging med biopsi eller ikke. Amplicor HPV-test var positiv for 29 % av prøvene med normal oppfølgingscytologi, 17 % av disse hadde CIN2-3 i oppfølgingsbiopsien. I vårt begrensede prøvemateriale var Proofer negativ i 1 % av CIN2-3 tilfellene med normal cytologi. Som et sikkerhetsnett, og i strid med retningslinjene, anbefaler Norchip at kvinner som har negativ Proofer mRNA test og normal oppfølgingscytologi, skal ta en ny cytologitest innen 6-12 måneder. Denne praksisen fører til økte kostnader og kan også virke paradoksalt siden HPV-testing ble innført for å øke sensitiviteten for ASCUS og LSIL cytologi. Norchips anbefalinger ble derfor ikke fulgt i vår studie.
Mange store studier, basert på sensitive HPV DNA-tester, har vist at en HPV-negativ cytologiprøve har høy negativ prediktiv verdi (9, 10). Dette gir en god sikkerhet for at disse kvinnene kan henvises til innkalling for ny rutinescreening etter tre år. Disse studiene viser også at primær HPV-screening er mer sensitiv enn dagens praksis i Norge med cytologi primærscreening og HPV som sekundærscreening. Flere land i Europa vurderer derfor å innføre HPV primærscreening i sine nasjonale screening program.
I det norske screeningprogrammet er det cytologisk diagnose sammen med HPV-resultat som bestemmer hvilken oppfølging kvinnene med ASCUS og LSIL cytologi skal få. For disse usikre og lavgradige diagnosene, er HPV-testing den mest sensitive måten å avgjøre hvorvidt kvinnene trenger oppfølging med biopsi eller ikke (2). Det er viktig at metoder som inkluderes for bruk i en screeningpopulasjon er validert for bruk i den populasjonen testen er ment å brukes i. Høy sensitivitet gir en høy negativ prediktiv verdi og HPV-negative kvinner kan trygt anbefales ny rutinescreening etter tre år. PreTect HPV-Proofer oppfyller ikke disse kravene per i dag.
Interessekonflikt
Ingen av forfatterne har interessekonflikter når det gjelder studiens design, innhenting av data, analysering og tolkning, skriving av artikkelen eller avgjørelsen om å fremlegge den for publisering. Prosjektbeskrivelsen ble på forhånd godkjent av de respektive produsentene av metodene og det ble gitt tillatelse til å publisere data uansett utfall for de forskjellige metodene. Alle produsentene fikk anledning til å lese den samme versjonen av artikkelen på forhånd og en del av kommentarene som fremkom ble tatt til følge i den originale artikkelen til Gynecologic Oncology.
Vi er svært takknemlig for bidraget fra de respektive produsentene med å dekke utgifter til reagenser og utlån av utstyr.
Referanser
- http://kreftregisteret.no/no/Forebyggende/Masseundersokelsen-mot-livmorhalskreft/Flytdiagram/
- Solomon D, Schiffman M, Tarone R. Comparison of three management strategies for patients with atypical squamous cells of undetermined significance: baseline results from a randomized trial. J Natl Cancer Inst. 2001 Feb 21;93(4):293-9.
- Stoler MH, Schiffman M. Interobserver reproducibility of cervical cytologic and histologic interpretations: realistic estimates from the ASCUS-LSIL Triage Study. JAMA. 2001 Mar 21;285(11):1500-5.
- Walboomers JM, Jacobs MV, Manos MM, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol. 1999 Sep;189(1):12-9.
- zur Hausen H, de Villiers EM, Gissmann L. Papillomavirus infections and human genital cancer. Gynecol Oncol. 1981 Oct;12(2 Pt 2):S124-8.
- Ovestad IT, Gudlaugsson E, Skaland I, et al. Local immune response in the microenvironment of CIN2-3 with and without spontaneous regression. Mod Pathol. 2010 Sep;23(9):1231-40.
- Ovestad IT, Gudlaugsson E, Skaland I, et al. The impact of epithelial biomarkers, local immune response and human papillomavirus genotype in the regression of cervical intraepithelial neoplasia grades 2-3. Journal of clinical pathology. [Research Support, Non-U.S. Gov't]. 2011 Apr;64(4):303-7.
- Burger EA, Kornor H, Klemp M, et al. HPV mRNA tests for the detection of cervical intraepithelial neoplasia: A systematic review. Gynecol Oncol. 2010 Dec 2.
- Anttila A, Kotaniemi-Talonen L, Leinonen M, et al. Rate of cervical cancer, severe intraepithelial neoplasia, and adenocarcinoma in situ in primary HPV DNA screening with cytology triage: randomised study within organised screening programme. Bmj. 2010;340:c1804.
- Naucler P, Ryd W, Tornberg S, et al. Efficacy of HPV DNA testing with cytology triage and/or repeat HPV DNA testing in primary cervical cancer screening. J Natl Cancer Inst. 2009 Jan 21;101(2):88-99.
























