Bakgrunn: Kun en liten andel av bakteriene i komplekse miljøer som jord, vann og sedimenter lar seg dyrke på syntetiske medier. Identifisering av flere bakterier vil gi ny viten om biosfærens samlede genetiske og metabolske potensial. Dessuten omfatter bakterielle produkter en rekke nyttige farmasøytiske midler, blant annet antibiotika hvor det er et sårt behov for nye tilskudd. Denne artikkelen tar for seg hvorfor mange taksa vanskelig lar seg dyrke og presenterer utvalgte strategier som er blitt brukt for å få flere bakterier til å vokse på laboratoriet.
Materiale og metode: Artikkelen er basert på en gjennomgang av tilgjengelig litteratur om utfordringer knyttet til dyrkning av bakterier på laboratoriet, ny forskning på feltet og på forfatternes egne erfaringer.
Resultater/Diskusjon: Strategien med å lage vekstmedier som i større grad gjenspeiler bakteriens naturlige miljø, har ført til at flere taksa enn tidligere nå kan dyrkes rutinemessig på agarskåler. Videre har mikrobiologer avdekket at noen bakterier kun vokser og deler seg med bidrag fra en hjelpestamme. Kokultur har gitt oss adgang til bakterier som ikke vokser alene på syntetiske medier. I en neste generasjons tilnærming, for eksempel ved bruk av diffusjonskammere, har forskere flyttet laboratoriet ut i felten. Fanget bak halvgjennomtrengelige membraner, men ikke avskjært fra molekylene rundt dem, vokser og deler bakteriene seg i miljøet der de hører hjemme. Vi har begynt å høste av disse teknikkene i form av nyttige stoffer produsert av bakterier som nå kultiveres for første gang. Likevel forblir mesteparten av bakteriene «udyrkbare» og deres eventuelle produkter er ennå ikke tilgjengelige for oss. Det er estimert at små molekyler produsert av bakterier utgjør 109 unike forbindelser og det er holdepunkter for å tro at noen av disse kan være nye klasser av antibiotika. Finpussing av eksisterende og utvikling av nye dyrkningsmetoder for mikrober vil gi oss adgang til og et mangfold av genetiske og biokjemiske ressurser av betydning for næringsmiddel-, farmasøytisk og kjemisk industri.
Nøkkelord: Agar, great plate count anomaly, kokultur, diffusjonskammer, nye produkter.
Dyrkning av bakterier, spesielt på agarskåler, er grunnpilaren i mikrobiologisk diagnostikk, kvalitetskontroll av næringsmidler (inkludert vann), farmasøytiske preparater, luftprøver og kosmetikk. Til tross for agarskålens sentrale rolle i analyse av pasientprøver, ser man at dyrkning på agar i økende grad erstattes av molekylær diagnostikk. På de mikrobiologiske laboratoriene i Norge har MALDI-TOF, PCR, sekvensering og utallige hurtigtester inntatt hverdagen. dyrkning av virus er så og si fjernet fra primærdiagnostiske laboratorier. Noe av den samme utviklingen har startet innenfor bakteriologi og soppdiagnostikk. Årsaken er raskere svar, strømlinjeformede oppsett og reduksjon i arbeidsbelastning, parallelt med økende prøvemengder. Innenfor pasientdiagnostikk er raske svar på tilstedeværelse av kjente patogener første prioritet, og det brukes mindre ressurser til å videreutvikle dyrkningsmetoder.
Imidlertid er det mange grunner til å jobbe iherdig mot å få flere bakterier til å vokse i renkultur på laboratoriet. Bakteriene som glimrer med sitt fravær på laboratoriemedier representerer sannsynligvis mesteparten av den metabolske diversiteten på kloden. Etter inntreden av metoder basert på genomikk, er det vist at 99 % av jordbakterier ikke lar seg dyrke på laboratoriemedier (1). Dessuten er ikke den dyrkbare andelen (<1 %) representativ for den totale fylogenetiske diversiteten i prøvene. I et estimat er omlag 31 av totalt 61 kjente bakterielle rekker (en kategori i biologisk systematikk mellom «rike» og «klasse») ennå ikke dyrket i laboratoriet (2). Å få adgang til denne skattekisten av biologiske og kjemiske transformasjoner er viktig av mange grunner. Det vil gi en bedre forståelse av karbon- og nitrogensykluser i biosfæren. Det kan gi bedre forståelse av metabolske tilstander som diabetes og overvekt, da hittil udyrkede mikrober i tarmens mikrobiota kan ha innvirkning på denne utviklingen. Det er også god grunn til å tro at det er en sterkt underbenyttet kilde til nye bioaktive forbindelser.
Det er estimert at små molekyler (< 1 kDa i størrelse) produsert av bakterier utgjør 109 unike forbindelser (3). Naturlige produkter fra bakterier og derivater av disse utgjør halvparten av alle kommersielt tilgjengelige farmasøytiske preparater (4). Det er preparater til behandling av kreft, infeksjoner og hyperkolesterolemi - og til bruk under organtransplantasjoner. I tillegg er bakterielle produkter også brukt som fungisider og insektisider.
Vi lever i en tid der antibiotikaresistens er i fokus. WHO publiserte i 2014 en rapport om antibiotikaresistens og oppfordret alle sine medlemsland til å lage nasjonale strategier for å redusere sitt antibiotikaforbruk (5). På grunn av den økende resistensutviklingen er det også stort behov for nye antibiotika. Ettersom mange antibiotika er sekundære metabolitter produsert av bakterier, vil man kunne forvente nye funn om flere taksa (flertall for taxon, betegnelse på konkrete systematiske grupper) blir dyrket fram for produksjon. Det er gode nyheter siden så godt som ingen nye typer antibiotika er utviklet i løpet av de siste 30 åra.
På forskningssida er dyrkning av bakterier i renkultur fortsatt den mest brukte metoden for å studere mikrobiell fysiologi og betydningen av gener, proteiner og metabolske ruter (2). Molekylære teknikker som omgår dyrkningstrinnet, for eksempel metagenomsekvensering, gir verdifull informasjon, men det er i praksis umulig å oppdage nye gen- og metabolske funksjoner fra DNA-sekvensdata alene. Dette glemmes lett når den teknologiske utviklingen raser videre med molekylære analyser i front. Konstruksjon av mutanter, hvor ett eller flere gener fjernes fra en mikrobe før den så dyrkes for å undersøke effekten, kombinerer begge tilnærminger. Denne fremgangsmåten har blitt brukt til å undersøke virkningsmekanismer til antibiotika så vel som resistensutvikling hos både bakterier (6) og sopp (7). For å fortsette kompetanseutvikling, forskning og studier av bakteriers samspill og konkurranse, må vi beherske et stort spekter av metoder og fremme enda bedre dyrkningsstrategier.
Sitatet To really know them you’ve got to grow them (8) forblir treffende selv om det er gjort store framskritt innen genomikk og transkriptomikk.
Denne artikkelen handler delvis om hvorfor de fleste bakterier er vanskelig å dyrke i renkultur på syntetiske medier. Det diskuteres også hvorfor det er viktig å lykkes i større grad enn det vi har gjort. Videre settes det søkelys på enkle, så vel som elegante og avanserte metodiske tilnærminger for å legge til rette for vekst av flere bakterier.
Materiale og metode
Artikkelen er basert på forfatternes egne erfaringer fra langvarig arbeid innen diagnostikk, oppdragsforskning og akademia. Det er ikke en fullstendig og systematisk gjennomgang av litteraturen, men et innblikk i problemer og utvalgte løsninger forbundet med dyrkning av mange bakterier på laboratoriemedier. Publikasjoner ble funnet ved søk i PubMed (søkeord: great plate count anomaly, nonculturable bacteria, diffusion chamber bacteria, R2A), med siste søk i mai 2017. Søket ga totalt over 1000 treff, hvorav 50 publikasjoner med relevante titler ble lest i sin helhet. 23 av disse som beskriver utfordringer med dyrkning og metoder for å omgå dette, ble valgt ut som referanser. Strategier for metoder som kan utføres på tradisjonelle mikrobiologiske laboratorier, ble benyttet som et inklusjonskriterium. Alle metoder som benytter forsøksdyr ble utelukket. Det er også presentert egne publiserte og upubliserte funn.
Resultater og diskusjon
Hvorfor er det så vanskelig å dyrke bakterier?
Ett av de store diskusjonstemaene i mikrobiologiens historie dreier seg om agarskålens begrensninger. Her snakker vi om den såkalte «great plate count anomaly» (heretter, GPCA) (9). For å illustrere dette kan man utføre et enkelt eksperiment. Hent litt grøftevann eller rist en klype jord fra lunsjrommets blomsterpotter ut i springvann. Utfør både mikroskopi og dyrkning på en næringsagar, og du vil se en dramatisk uoverensstemmelse mellom antall celler i mikroskopet og antall kolonier på agaren. Uoverensstemmelsen (i favør av celler i mikroskopet) vil være GPCA. Mikrobiologer har ikke hatt annet valg enn å konkludere med at de aller fleste bakteriene, og dermed mye av klodens biodiversitet, ikke lar seg dyrke fram på syntetiske medier for nærmere undersøkelse.
Den enkle forklaringen på hvorfor så få mikrober vokser i laboratoriet er utfordringen med å reprodusere mikrobenes naturlige miljø. Mange mikrober som er sykdomsfremkallende for mennesker og dyr, har enkle behov for næringsstoffer og har opphav i miljøer med relativt høye konsentrasjoner av organisk materiale. Klassiske eksempler på disse er Escherichia coli og beta-hemolytiske streptokokker. Disse er enkle å dyrke og identifisere ved hjelp av næringsrike medier og inkubasjon ved kroppstemperatur. Til sammenligning vokser mange bakterier med opphav i rent vann sakte, og kun ved en lavere konsentrasjon av næringsstoffer og lavere temperaturer. Gode eksempler er bakterier i flaskevann som stammer fra uberørte kilder som isbreer.
Bakterier i komplekse miljøer som jord og sjøvann har helt andre forutsetninger for vekst, og det bakterielle miljøet formes av tilgang på ressurser, konkurranse med andre organismer og forekomst av predatorer. Å reprodusere naturlige forhold in vitro, med representative næringsstoffer, pH, osmotisk trykk, temperatur og lysforhold (for å nevne noe), er en tilnærmet uoverkommelig oppgave for det enorme spekteret av mikrober som i dag ikke er dyrket fram.
Bidrar agarpulver til GPCA?
En fascinerende studie publisert i 2014 (10) går langt i å legge mye av skylda for GPCA på agarpulver sammen med fosfat. Forskningsgruppen som står bak arbeidet hadde tidligere rapportert at bruk av gellan gum i stedet for agar i fosfatholdige medier, ga raskere vekst av kolonier og en mer variert sammensetning av bakterier (11). Ta en titt i medieskapet på arbeidsplassen og du vil se at mange standardmedier (for eksempel «brain heart infusion agar» og «m-Enterococcus agar» mfl.) inneholder relativt mye fosfater. Det har lenge vært kjent at autoklavering av medier med vesentlig innhold av fosfater kan gi delvis eller fullstendig hemming av bakteriell vekst, men de spesifikke faktorene som fører til dette har i stor grad vært ukjente (12).
Tanaka og kolleger viste at standard framgangsmåte for medielaging, der agar autoklaveres sammen med fosfat, produserer hydrogenperoksyd (H2O2) i konsentrasjoner som stopper veksten av mange bakterier i jordprøver. Skåler tillaget uten fosfat eller ved å blande agar og fosfat etter autoklavering, økte antallet kolonier inntil 50 ganger. Enda mer slående var det at bakterieblandingen som vokste fram på medier tillaget uten kontakt mellom agar og fosfat under autoklavering, gjenspeilet det bakterielle innholdet i jord som ble avdekket gjennom neste generasjons sekvensering. Konsentrasjonen av fosfat i ovennevnte kommersielt tilgjengelige medier er høyere enn i mediene benyttet i Tanakas studier. Det er derfor sannsynlig at det dannes H2O2 under autoklavering av også disse mediene.
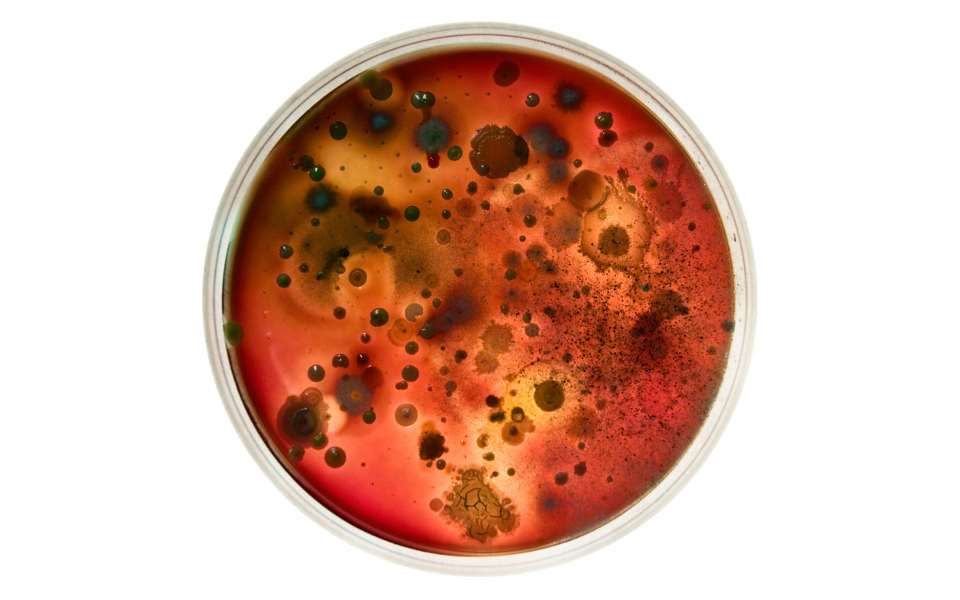
Data fra Tanaka og medarbeidere beviser ikke med hundre prosent sikkerhet at autoklavering av agar og fosfat sammen direkte eller indirekte er årsaken til H2O2-dannelse. Det er for eksempel ikke tatt i betraktning at agarpulver kan inneholde kontaminanter og at det er disse heller enn agar i seg selv som er med på å danne H2O2. Dette er noe vår gruppe undersøker i skrivende stund. Figur 1 fra vårt laboratorium viser vekst av flaskevannsbakterier på «brain heart infusion»-agar. En agarskål ble behandlet med katalase (som spalter H2O2), mens den andre agarskålen var ubehandlet. Skålen som var behandlet med katalase ga vekst av et større mangfold av kolonier, og viser at H2O2 hemmer vekst av enkelte mikrober.

Strategier for å få flere bakterier til å vokse
Det er ingen kjente grunner til at ikke alle bakterier kan dyrkes på laboratoriet. Det logiske utgangspunkt for ny giv er å skape vekstforhold som er mest mulig lik de som bakteriene normalt vokser og deler seg i. En rekke metoder er utviklet for å bedre vekstvilkår for bakterier. Noen innebærer dyrkning in vivo i forsøksdyr, for eksempel bakteriefrie mus. De blir ikke diskutert i denne artikkelen, men vi vil presentere tre utvalgte strategier for å redusere GPCA som det forskes aktivt på. De tre strategiene er valgt fordi de er enkle og fordi de kan utføres uten store investeringer. En større oversikt finnes i artiklene til Stewart (3) og Stevenson et al (13).
Tre strategier:
1) Å skreddersy dyrkningsforhold og vekstmediets sammensetning for å etterligne bakteriens naturlige omgivelser. Herunder omtales også bruk av metatranskriptomiske analyser som grunnlag for å utvikle medier
2) Å dyrke bakterien sammen med en annen hjelpebakterie fra samme miljø (i kokultur). Mange bakterier som ikke vokser i renkultur på agarskåler har behov for vekstfaktorer produsert av andre bakterier.
3) Å dyrke bakterien i sitt naturlige miljø. Det er utfordrende å gjenskape et komplekst miljø med en høy grad av autentisitet. Dessuten vet man ikke på forhånd hvilke faktorer som må være på plass for at et bestemt takson vil gå inn i en vekst- og delingsfase. En strategi som er tatt i bruk er å dyrke bakterien der den hører hjemme og flytte laboratoriet ut i felten.
1. Å skreddersy dyrkningsforhold
En strategi som benyttes for å fremme vekst av mikrober er å lage vekstmedier som etterlikner bakterienes naturlige omgivelser. R2A (14) er et medium som er allment kjent for ingeniører og forskere som driver med vannanalyse, og som har gjort det mulig med rutinemessig dyrkning av flere bakterier (inkludert flere taksa) fra ferskvann enn tidligere. For å nærme seg konsentrasjoner av karbon- og energikilder i miljøet, har R2A lav konsentrasjon av næringsstoffer (men fortsatt 800 ganger mer enn for eksempel drikkevann). Utvalget av næringsstoffer er også noe mer variert enn i drikkevann. I tillegg skiller R2A seg ut ved at det inneholder komponenter til et buffersystem (for å holde en fysiologisk pH for vekst), komponenter som motvirker oksidativt stress (en konsekvens av aerob vekst) og stivelse som nøytraliserer toksiske forbindelser (for eksempel klorrester i drikkevann).
En annen strategi for å tilnærme seg bakteriens naturlige miljø er å «bake» dette inn i mediet. Et godt eksempel er soil-extract agar: Jord (gjerne fra miljøet som skal undersøkes) ristes ut i vann, og supernatanten etter sentrifugering brukes til framstilling av agaren. Slike medier er også kommersielt tilgjengelig i dag (for eksempel Himedia®, India). Nye arter tilhørende alphaproteobakterier er dyrket på denne agaren (15).
Metatranskriptomikkanalyser som grunnlag for å utvikle medier
Det er først når en bakterie begynner å vokse og dele seg at det blir mulig å undersøke hva som kjennetegner en aktiv veksttilstand. Å studere bakterier mens de vokser i sine naturlige miljøer kan gi oss verdifulle tips for produksjon av et skreddersydd vekstmedium. Bomar og medarbeiderne (16) utførte neste generasjons sekvensering av RNA-transkripter produsert av en til da ikke tidligere dyrket Rikenella-lignede bakterie som har sitt naturlige tilholdssted i igletarm. Analysen ga en klar pekepinn på hvilke karbon- og energikilder bakterien benyttet. Gruppen fant høyt uttrykk av gener relatert til bruk av mucin (et glykosylert protein produsert av tarmepitelet) og resultatene tydet på at muciner var bakteriens hovedkarbon- og energikilde. Basert på denne informasjonen klarte gruppen å dyrke bakterien ved det enkle grep å ha med mucin i agarskålene. I denne meget elegante tilnærmingen brukte forskerne tips fra bakterien om hvordan vekstmediet bør skreddersys for å tillate dyrkning i renkultur. Når man har identifisert X-faktoren for ulike mikrober, kan dette utnyttes for å lage ulike medier og dyrkningsforhold in vitro.
Analytiske grep
I tillegg til nøye tilpasning av mediets sammensetning til den enkelte bakterien, finnes det analytiske grep som kan vurderes for å gi vekst av flere arter. For dyrkning av saktevoksende bakterier, vil en reduksjon i inokulumstørrelsen være lurt. Flere skåler og mindre prøvemateriale vil redusere sjansene for at hurtigvoksende bakterier overvokser andre kolonier. Det vil også redusere effekten til eventuelle veksthemmende stoffer i prøvematerialet (for eksempel fenoler fra plantemateriale). Lengre inkubasjonsperioder, lavere temperaturer og bruk av agarskåler med redusert vanninnhold (slik at bevegelige bakterier ikke sprer seg over andre) kan være nyttig. Analytikerne bør alltid ha i tankene at agarkultur fungerer best for den lille andelen av arter som er hurtigvoksende. Andre bakterier vil kunne vokse (og synes!) om man tipper balansen i deres favør.
Ved å legge brikke på brikke kan man komponere et vekstmedium som etterlikner «hverdagen» til bakterier i et bestemt eller beslektede miljøer, og dermed øke antallet og typer bakterier som vokser. Likevel har ikke denne strategien gitt overbevisende resultater med tanke på tiden som er investert. Dyrkning på agar tilfører kun abiotiske faktorer og kan umulig gjenspeile det biologiske mangfoldet bakterien normalt lever i.
2. Kokultur på agar
Forsøk på å isolere bakterier i renkultur kan ødelegge nødvendig kommunikasjon mellom celler. Noen bakterier mangler evnen til å produsere en eller flere substanser som er nødvendig for vekst og kolonidannelse, men kan utnytte forbindelser produsert av andre bakterier når de er tett på hverandre. Biofilm er et eksempel på en arena der kokultur og produktutveksling skjer naturlig. Det er derfor først når en donor- og en mottakerbakterie havner nært hverandre på en agarskål at betingelsene for vekst in vitro oppnås. D’Onofrio og medarbeiderne (17) observerte flere kolonier av marine bakterier på agarskåler med tett vekst enn på agarskåler med få kolonier, til tross for korrigering for fortynningsfaktor. Det ble spekulert i om noen av bakteriene som vokste på skåler med høy kolonitettet kun vokste takket være et eller annet bidrag fra nabokolonier. For å undersøke hypotesen ble kolonier som vokste nær hverandre inokulert parvis på agar i kryssende utstryk. På denne måten kunne det fastslås om nærvær av en annen bakterie stimulerte, hemmet eller ikke hadde noen effekt på veksten. Flere hjelper/mottaker bakteriepar ble avdekket på denne måten. Etter identifisering av bakteriene, gikk fase to ut på å undersøke hva avhengigheten skyldtes. E. coli ble identifisert som en hjelpestamme for en rekke bakterier. E. coli skiller kun ut et begrenset spekter av molekyler og alle disse er nå identifisert. Det var derfor en enkel sak å identifisere X-faktoren ved å bruke en serie E. coli-mutanter som hver manglet evnen til å produsere ett av de utskilte molekylene. X-faktoren i dette tilfellet viste seg å være et siderofor (enterobactin) (figur 2). Sideroforer er molekyler med lav molekylvekt som har høy bindingsaffinitet for ikke-vannløselig treverdig jern (Fe(III)). Mikroorganismer frigjør sideroforer til miljøet for å få tak i Fe(III) og tar deretter opp dette i cellen.
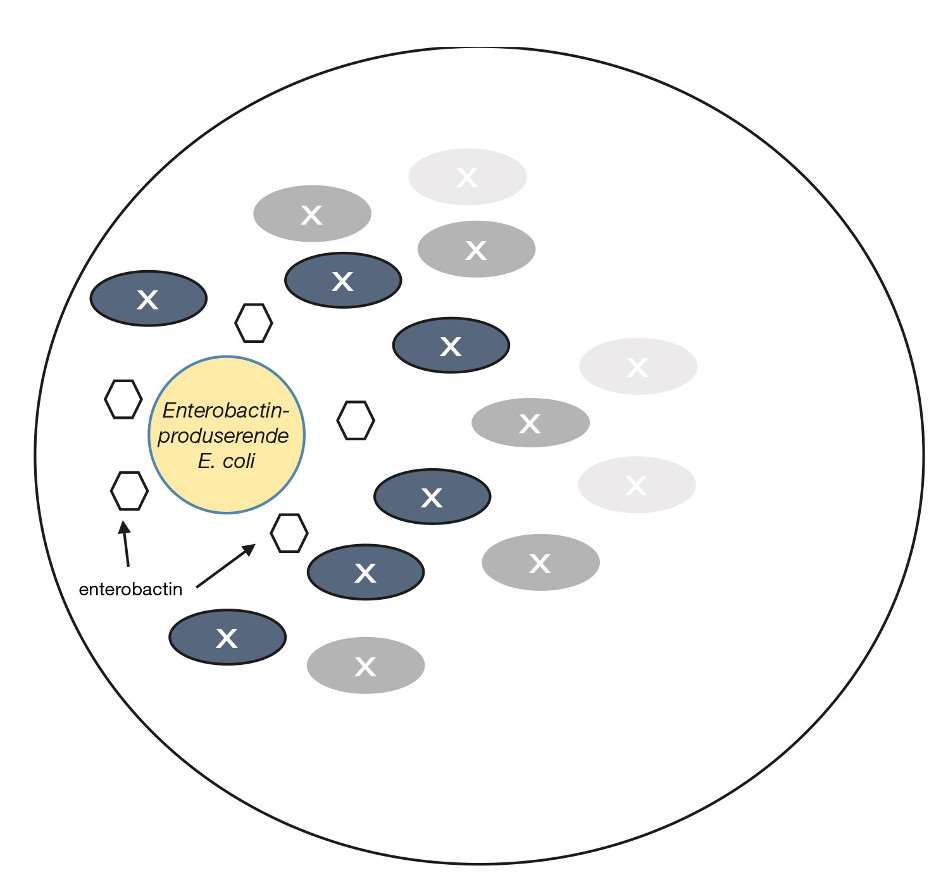
Kokultur tilfører et ekstra biologisk element til en optimalisert agarskål. Selv om dyrkningsmiljøet fortsatt er unaturlig, har denne metoden vist seg å være svært effektiv. Det er imidlertid ikke slik at en størrelse passer alle, og samspillet mellom hjelpere og mottakere kjennetegnes av både kompleksitet og selektivitet. Sideroforer er bare en av flere klasser av signal-/effektormolekyler som bakterier produserer. Et kjent eksempel for de fleste bioingeniører på mottaker/hjelperstamme er Haemofilus influenzae som kan vokse på blodagar inntil en stafylokokk (satelittvekst).
Vi har fortsatt en lang vei å gå for å forstå hvor omfattende detaljstyring og gjensidig påvirkning er innad i bakterielle populasjoner. Dette er et felt innen mikrobiell økologi som nok kommer med flere overraskelser i årene framover og som kan bidra til å krympe GPCA ytterligere.
3. Dyrke bakterier i sitt naturlige miljø
I sin enkleste form er et diffusjonskammer et lite rom hvor bakteriene er fanget i næringsfri-agar bak halvgjennomtrengelige membraner som slipper inn næringsstoffer og vekstfaktorer, og slipper ut avfallsstoffer. Plasseres kammeret i bakteriens naturlige miljø (jord, vann, munnhulen) får cellene tilnærmet naturtro vekstbetingelse og vil kunne vokse og danne mikrokolonier. I et naturlig miljø vil bakteriene respondere på en rekke faktorer og kan være involvert i både symbiotiske og antagonistiske forhold med andre bakterier, sopp, små dyr og planter. Allerede i 2002 viste Kaeberlein og medarbeidere at denne tilnærmingen tillot dyrkning av opptil 40 % av bakterier fra marine sedimenter (18). Renkulturer kan lages ved å overføre mikrokolonier til nye kammere. Ichip (19) er en videreutvikling av denne teknologien. Ichip har ca 400 kammere og kan senkes ned i en kompleks blanding av mikrober i en miljøprøve (for eksempel elvevann, sjøvann, tarmprøver, blod). Ved å måle utgangskonsentrasjonen av mikrober i prøven, kan man fortynne seg fram til en konsentrasjon som gjør at bakteriene kan isoleres hver for seg (figur 3). Isolert i hvert sitt diffusjonskammer slipper cellene å konkurrere med andre celler, for eksempel hurtigvoksende arter, og kan vokse som renkultur. Ichip er blitt brukt til å kultivere flere hundre bakterier som vanskelig lar seg dyrke. Et viktig resultat av dette har vært oppdagelsen av det som er blitt omtalt som den første ny klasse av antibiotika (Teixobactin) på 30 år (20). Hva mer har vi i vente?

Kombinasjon av strategier for å øke produksjon av bioaktive forbindelser
Når man har funnet løsningen på hvordan ulike bakterie kan vokse, åpner det seg mange muligheter for produksjon av bioaktive forbindelser. Kandidater for produksjon av antibiotika og andre produkter kan dyrkes fram med den såkalte OSMAC–tilnærmingen, «One strain many compounds» (21). OSMAC- tilnærmingen handler om å variere dyrkningsforhold for en bakterie for å få bakterien til å produsere ulike forbindelser. Nøye regulering av genuttrykk gjør at bakteriene kun vil produsere de produktene de har behov for i ethvert miljø. Begrensing til ett dyrkningsmiljø gir begrensning i produksjon av bioaktive forbindelser. Å dyrke bakteriene på ulike måter kan derfor gi opphav til en rekke nye forbindelser som kan utnyttes i medisin. For eksempel kan bakteriene produsere ulike forbindelser med ulik tilgang til oksygen. Tilsetning av enzymhemmere eller faktorer som påvirker det epigenetiske maskineriet kan også påvirke bakteriens genuttrykk. En studie fra 2014 (22) viste at kokultur med ulike bakterier og sopp økte det kjemiske mangfoldet i mikrobenes metabolitter. Forfatterne viste at konkurranse mellom mikrobene framprovoserte stress og dermed uttrykk av biosyntetiske gener som ikke normalt uttrykkes under in vitro forhold. OSMAC-tilnærmingen vil trolig i årene framover gi opphav til en rekke nye genetiske og biokjemiske forbindelser.
Konklusjon
Kun er liten andel av jordas bakterielle diversitet er i dag mulig å dyrke fram i laboratoriet. Fordi bakterier utgjør en stor andel av jordas biomasse, er trolig mye av vår planets metabolske potensial både ukjent og uutnyttet. I tillegg er mange naturlige produkter som benyttes innen medisin, blant annet antibiotika, produkter fra dyrkede bakterier. For å få tilgang til flere bioaktive forbindelser er det viktig å få flere og bedre metoder for å dyrke bakterier, slik som beskrevet i denne artikkelen. Både nye antibiotika og andre molekylklasser med antimikrobiell aktivitet, er potensielle forbindelser som kan bli et resultat av forbedrede dyrkningsmetoder. En rekke nye publikasjoner i noen av verdens ledende tidsskrift, illustrerer viktigheten av og aktiviteten på dette området.
Denne artikkelen har lykkes dersom leseren har fått en bedre forståelse for hvorfor vi kun har klart å dyrke en brøkdel av klodens bakterier og samtidig hvorfor det er viktig å forske videre på dette området. Her er det sannsynligvis snakk om en skattekiste av nyttige biologiske molekyler som vi så vidt har fått et glimt av. Vi har også prøvd å gi et lite innblikk i nye tilnærmingsmåter for å få adgang til disse ubenyttede ressursene.
Les intervjuet med Colin Charnock:
"Målet er nye antibiotika"