Hovedbudskap
- Funksjonelle proteinanalyser utgjør en viktig del av utredningen av genvarianter assosiert med MODY
- American College of Medical Genetics and Genomics (ACMG) har utgitt retningslinjer for bruk av funksjonelle data for klassifisering av genvarianter
- Vurdering av patogen effekt av genvarianter bygger på godt studerte genvarianter som kvalitetskontroll i individuelle analyser
- Genetisk og funksjonell MODY-diagnostikk er viktig i persontilpasset behandling av pasienter
Av LISE BJØRKHAUG GUNDERSEN og INGVILD AUKRUST
MODY (Maturity-Onset Diabetes of the Young) er en arvelig form for ikke-insulinavhengig type diabetes mellitus (1). Diagnosen baseres på typiske kliniske symptomer og identifisering av sykdomsgivene (patogen) genmutasjon som årsak til MODY. Hensikten med artikkelen er å belyse viktigheten av funksjonelle proteinanalyser for å evaluere konsekvensen av MODY-genvarianter, for en presis MODY-diagnose og for persontilpasset medisin for pasienter med utvalgte subtyper av MODY. Artikkelen gir en oversikt over karakterisering, årsak og utvikling av vanlige former for diabetes og MODY og funksjonelle proteinanalyser som er relevant innen diagnostikk av enkelte MODY-subtyper.
Diabetes mellitus
Diabetes mellitus er en kronisk sykdom som oppstår når kroppens bukspyttkjertel enten ikke produserer nok insulin, eller når kroppen ikke klarer å effektivt dra nytte av insulinet som produseres. Insulin er et hormon som regulerer blodsukkeret (2). Hyperglykemi, eller forhøyet blodsukker, er en vanlig effekt av ukontrollert diabetes, som over tid fører til alvorlig skade på mange av kroppens systemer, spesielt nerver og blodårer.
På verdensbasis øker forekomsten av diabetes kraftig. Mer enn 537 millioner lider av diabetes i dag, og forekomsten er predikert å øke til 700 millioner innen år 2045, på grunn av livsstilsfaktorer som fedme og inaktivitet (2). Ifølge The American Diabetes Association kan diagnosen diabetes bli satt enten når fastende plasmaglukose (FGP) er > 7,0 mmol/L, eller etter en 75g glukosetoleransetest, der plasmaglukosekonsentrasjonen er > 11,1 mmol/L, to timer etter test. HbA1c er andelen hemoglobin som har bundet glukose. HbA1c-nivå, som et mål på langtidsblodsukkeret, kan også bli brukt som markør for kronisk glykemi. En konsentrasjon > 47,5 mmol/mol (6.5%) er anbefalt som diagnostisk grense for diabetes (3). I tillegg, om pasienten har klassiske symptomer på hyperglykemi eller en hyperglykemisk krise, kan diagnosen settes ved tilfeldig nivå av plasmaglukose > 11,1 mmol/L (3).
Diabetes type 1
Diabetes type 1 (T1D) (tidligere kjent som insulin-avhengig, juvenil eller barnediabetes) er karakterisert ved mangelfull insulinproduksjon, ikke-målbare konsentrasjoner av plasma C-peptid, og ketoacidose (økte nivåer av ketoner grunnet forlengede perioder av hyperglykemi) (2).
Symptomer ved T1D inkluderer økende urinering, tørste, konstant sult, vekttap, synsforandringer og tretthet. Slike symptomer kan oppstå plutselig. Andre karakteristiske trekk ved T1D er tidlig debut (vanligvis <40 års alder) hos barn/unge voksne, og tilstedeværelse av autoantistoffer (GAD, IA-2, IA-2β, ICA, ZnT8) (2). Slike autoantistoffer er markører for ødeleggelse av bukspyttkjertelens β-celler. Tilstedeværelse av disse, sammen med ikke-målbare konsentrasjoner av plasma C-peptid, er viktige indikatorer for diagnostisering av T1D (2).
Sykdommen, som utgjør rundt 5-10% av all diabetes, krever daglig administrering av insulin. Verken årsaken til sykdommen eller preventive tiltak er godt kjent. En kompleks interaksjon mellom genetikk og miljøfaktorer som virale infeksjoner har vært assosiert med utviklingen av sykdommen.
Diabetes type 2
Diabetes type 2 (T2D) (tidligere kalt ikke-insulinavhengig eller adult-onset) forårsakes av kroppens manglende effektive bruk av insulin. Hyperglykemien oppstår på grunn av nedsatt insulinsekresjon og/eller insulinresistens, og er karakterisert ved manglende vevsrespons til insulin (4). Over 90% av diabetespopulasjonen har T2D (2).
Denne formen for diabetes er hovedsakelig et resultat av høy kroppsvekt og fysisk inaktivitet. I motsetning til T1D blir sykdommen ofte diagnostisert flere år etter debut, og etter at komplikasjoner (mikro-/makrovaskulære) har oppstått. Sykdommen manifesterer seg vanligvis hos eldre voksne (>40 års alder), men sees også hyppigere hos barn og ungdom på grunn av økende forekomst av fedme hos disse gruppene.
Når sunt kosthold og fysisk aktivitet alene ikke er tilstrekkelig for å opprettholde et normalt blodsukkernivå, kan aktuell behandling mot T2D inkludere metformin (senker blodsukkeret og øker cellenes sensitivitet for insulin), sulfonylurea (senker blodsukkeret ved å stimulere betacellenes insulinproduksjon) og insulin (2, 3). T2D er definert som en kompleks heterogen sykdom, assosiert med en sterk genetisk predisposisjon. En kompleks interaksjon av flere gener (polygen diabetes) og miljøfaktorer er antatt som årsak til sykdommen (5).
Svangerskapsdiabetes
Svangerskapsdiabetes er en type diabetes som kan oppstå under graviditeten (6). Dette skjer hvis kroppen ikke klarer å møte det økte behovet for insulin under graviditet. Årsaken til at noen utvikler svangerskapsdiabetes er kompleks, der arv, overvekt eller tidligere svangerskapsdiabetes kan være utslagsgivende faktorer. Dersom kosthold og regelmessig mosjon ikke senker blodsukkeret tilstrekkelig, kan behandling med insulin være aktuelt.
Ubehandlet kan svangerskapsdiabetes være skadelig for både mor og barn. Sykdommen kan medføre høyt blodtrykk og svangerskapsforgiftning hos mor, og høy vekt og lavt blodsukker hos barn ved fødsel. Svangerskapsdiabetes forsvinner vanligvis etter fødselen, men kan hos mor gi økt risiko for utvikling av fedme og T2D senere i livet.
Maturity-Onset Diabetes of the Young
Maturity-Onset Diabetes of the Young (MODY) er en autosomal dominant nedarvet form for monogen diabetes. MODY ble først beskrevet i 1974 av Robert Tattersall (1). Senere har det blitt vist at MODY består av en gruppe heterogene sykdommer, forårsaket av heterozygote sykdomsgivende genvarianter i gener som er viktige for normal β-celle-funksjon og utvikling (7). Patofysiologiske kjennetegn ved MODY er progressiv dysfunksjon av bukspyttkjertelens β-celler, som fører til ikke-insulinavhengig diabetes med tidlig debut; vanligvis i alderen 25-35 år. MODY-pasienter er ofte normalvektige og har en sterk familiehistorie med diabetes. Vanligvis ser en at ~50% av familiemedlemmer har diabetes grunnet nedarvet genmutasjon. Det kliniske bildet er også karakterisert med målbar C-peptid, fravær av β-celleautoimmunitet, og insulinresistens (8).
Materiale og metode
Artikkelen er basert på forfatternes egne erfaringer med gendiagnostikk av pasientgruppen, og relevans av funksjonelle data fra norske og utenlandske MODY-genvarianter. Artikkelen baserer seg også på litteratursøk i PubMed, der følgende søkeord ble brukt; «Maturity-Onset Diabetes of the Young», «diabetes type 1», «diabetes type 2», «svangerskapsdiabetes», og utført i kombinasjon med «treatment of». Videre ble søkeordet «functional analysis» i kombinasjon med «MODY mutations», «HNF1A», «HNF1B», eller «HNF4A» benyttet. For diabetes type 1 og diabetes type 2 ble søket begrenset til review med publikasjonsdato fra siste år (free full text). Søket ble utført 30. mars 2022 og 3114 artikler ble generert. 41 artikler ble vurdert.
MODY-subtyper og forekomst
MODY er en sjelden sykdom og estimert å utgjøre rundt 1-3% av all diabetes (Figur 1).
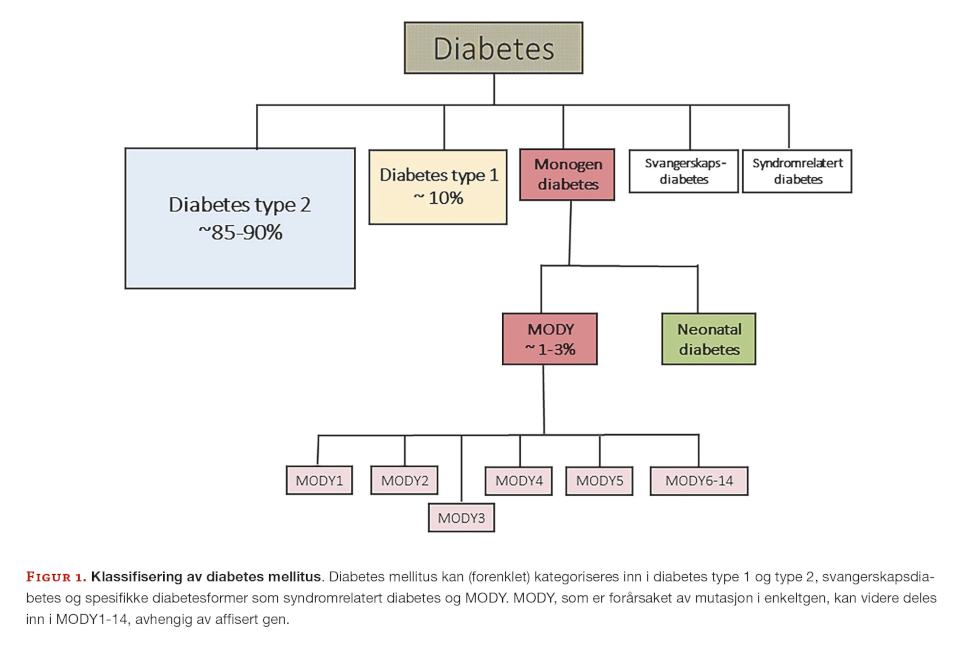
14 forskjellige subtyper av MODY har blitt oppdaget hittil. Hver subtype er forårsaket av mutasjon i ett enkeltgen, der mutasjon i 14 individuelle gen (HNF4A, GCK, HNF1A, PDX1, HNF1B, NEUROD-1, KLF-11, CEL, PAX4, INS, BLK, ABCC8, KCNJ11, and APPL1) forårsaker MODY1-14 (Tabell 1).
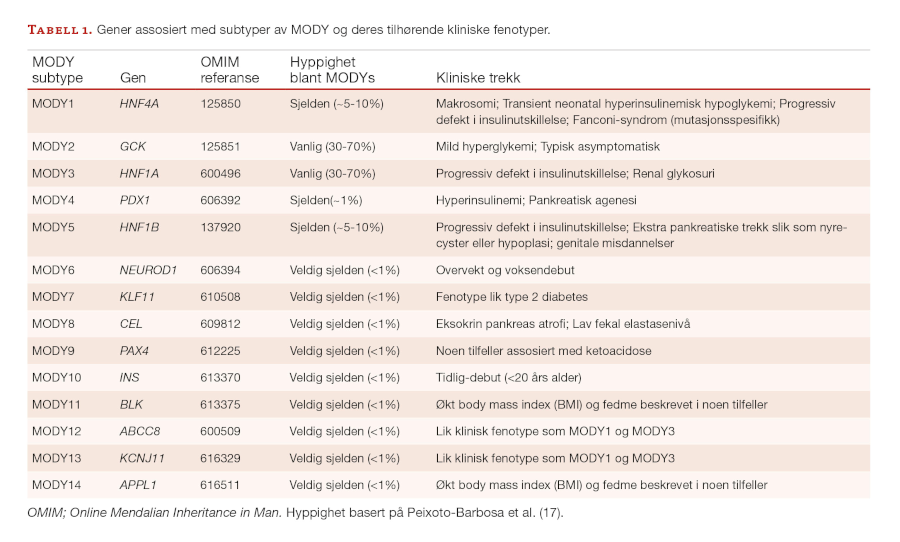
Disse genene har vist seg å være viktige for normal funksjon av bukspyttkjertelens β-celler. De hyppigst forekommende subtypene av MODY er forårsaket av mutasjoner i tre transkripsjonsfaktorer (HNF4A, HNF1A og HNF1B) og i glukokinasegenet (GCK) (9-12), og resulterer i henholdsvis MODY1, MODY3, MODY5 og MODY2.
En nøyaktig estimering av hvor hyppig MODY generelt forekommer er utfordrende. Én årsak til dette kan være mangel på kunnskap om eksistens av MODY. En annen årsak er at noen MODY-pasienter viser overlappende kliniske trekk og presentasjon av sykdom som kan forveksles med pasienter som har T1D eller T2D (Tabell 2) (13-15).
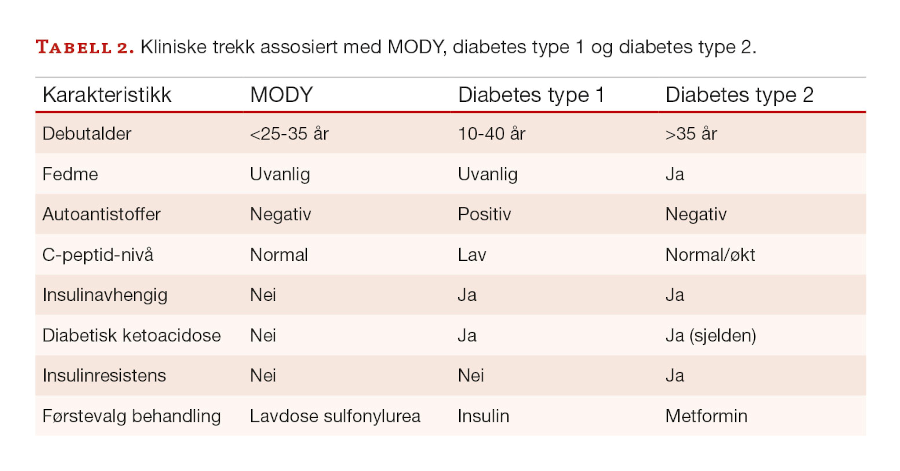
Dette fører til at så mange som 90% av MODY-pasienter er antatt feildiagnostisert med T1D eller T2D, og fører dermed også til feil behandling (8).
Pasienter med forskjellige subtyper av MODY har felles kliniske trekk som nedsatt insulinsekresjon og hyperglykemi. Kliniske rapporter viser likevel at noen utvikler forskjellige komplikasjoner senere i livet, der pasienter med eksempelvis MODY1 og MODY3 har stor risiko for utvikling av mikrovaskulære komplikasjoner, mens pasienter med MODY5 utvikler cyster i nyrene eller problemer i urogenital trakt (16). Behandlingstilbudet er dermed også forskjellig. Pasienter med MODY1 og MODY3 kan ofte behandles med tabletter (sulfonylurea) eller insulin, avhengig av alvorlighetsgraden av symptomene, mens MODY5-pasienter behandles med insulin (16).
MODY2 og MODY3 er estimert å individuelt utgjøre rundt 30-70% av alle MODY-tilfeller på verdensbasis, mens MODY1 og MODY5 utgjør rundt 5-10% (17). Norske pasienter er registrert i det norske MODY-registeret. Registeret utgjør i dag cirka 1520 personer (probander)/familier. Av dem som har fått en genetisk MODY-diagnose, er MODY2 og MODY3 hyppigst forekommende (38% og 41%), mens MODY5 og MODY1 utgjør henholdsvis 10% og 5% av pasientene. I MODY-registeret finnes også pasienter med antatt MODY, men der man per i dag ikke har funnet noen patogen genvariant i kjente MODY-gen.
Gendiagnostikk av MODY
På grunnlag av forskjeller i sykdomsutvikling, prognose og behandling, er en presis diagnose av MODY-subtype viktig. Dette for å sikre effektiv og persontilpasset oppfølging av spesifikk sykdom, behandling, genetisk veiledning for familien og for å redusere risiko for utvikling av diabeteskomplikasjoner senere i livet (16). Genetiske analyser for diagnose av MODY-subtype innebærer Sanger-sekvensering eller Next-Generation-Sequencing (NGS). Utgangspunktet er pasientens DNA, ekstrahert fra blod. Screening av MODY-gen(er) som er mest relevant å undersøke bestemmes ut ifra pasientens kliniske symptomer. Normalt sett undersøkes også flere individer i pasientens familie, for å bekrefte samme genvariant hos individer med tilsvarende symptomer på MODY og avkrefte variant hos friske individer i pasientens familie.
Klassifisering av genvarianter
En endelig MODY-diagnose avhenger hovedsakelig av kliniske kriterier og funn av patogen genvariant i MODY-gen. For å vurdere hvorvidt en genvariant er patogen eller ikke, benyttes en veileder etablert av American College of Medical Genetics and Genomics (ACMG) (18). ACMG er en tverrfaglig profesjonell medlemsorganisasjon som representerer det medisinsk genetiske fagfeltet, inkludert kliniske genetikere, kliniske laboratoriegenetikere, og genetiske veiledere. ACMG arbeider blant annet med å etablere standarder for laboratoriepraksis, herunder veileder og klassifiseringssystem for å evaluere og differensiere DNA-varianter i mendelske (arvelige) sykdommer.
Klassifisering av genvarianter innebærer plassering av slike i én av fem grupper: patogen (klasse 5), sannsynlig patogen (klasse 4), usikker signifikans (klasse 3), sannsynlig benign (klasse 2) og benign (klasse 1). Den integrerte softwaren Alamut blir brukt til å hente informasjon fra ClinVar (klinisk database med informasjon om tidligere funn av genvarianter) og frekvensdatabasen GnomAD. Sistnevnte er en database med genvarianters frekvens i en multietnisk populasjon på over 170 000 individer (19) og blir benyttet for å sjekke om pasientens genvariant er sjelden eller hyppigere forekommende i en generell populasjon.
I Alamut finner man også informasjon om hvor konservert området (aminosyren) varianten påvirker er, og gir tilgang til verktøy som kan beregne sannsynlighet for at en genvariant kan påvirke et spleisesete i et gen. I tillegg hentes informasjon fra Human Gene Mutation-databasen, hvor man kan finne publiserte artikler om pasientens genvariant. Når man har samlet all informasjon om den aktuelle genvarianten klassifiseres den av kliniske laboratoriegenetikere/molekylærbiologer, i samarbeid med leger, ved medisinsk genetiske laboratorier, i henhold til anbefalinger i ACMG sine retningslinjer (18).
Ifølge retningslinjene fra ACMG og ClinGens arbeidsgruppe for varianttolkning, bidrar data fra funksjonelle analyser (beskrevet under) i stor grad som sterkt/moderat bevis for en mer nøyaktig diagnostisk klassifisering av genvarianter. Hittil har det blitt oppdaget flere hundretalls genvarianter, som påvirker den proteinkodede delen i de hyppigst affiserte MODY-genene. Da noen MODY-gen har vist seg å være såkalte klinisk «handlingsdyktige gener», kan data fra slike funksjonelle analyser være et viktig bidrag i både den endelige MODY-diagnostikken og for å kunne anbefale mer persontilpasset behandling av pasienter. Som oftest kan dette innebære en endring fra insulinbehandling til tabletter (sulfonylurea) (16).
Funksjonell MODY-diagnostikk
MODY-genene HNF4A, HNF1A og HNF1B koder for henholdsvis hepatocytt nukleær faktor -4A, -1A og -1B. Disse er transkripsjonsfaktorer som regulerer transkripsjon av et bredt spekter av gener, som for eksempel insulin, og andre gener med viktige roller i glukosemetabolismen og utviklingen av bukspyttkjertelens β-celler (21). Transkripsjonsfaktorene er bygget opp av forskjellige proteindomener, som hver har sin unike rolle i faktorenes overordnede funksjon i cellekjernen. Forskere i diabetesforskningsgruppen i Bergen (Universitetet i Bergen/Høgskulen på Vestlandet) har utviklet skreddersydde analyser som kan vurdere den funksjonelle effekten en genvariant har for funksjonen til sin respektive MODY-transkripsjonsfaktor.
Slike funksjonelle analyser har vist at genvarianter hovedsakelig medfører redusert proteinfunksjon, og innebærer en defekt i transkripsjonsfaktorens i) DNA-binding, ii) transaktivering/regulering av sine målgener, iii) kjernelokalisering eller iv) totalproteinnivå (Figur 2) (22-26).
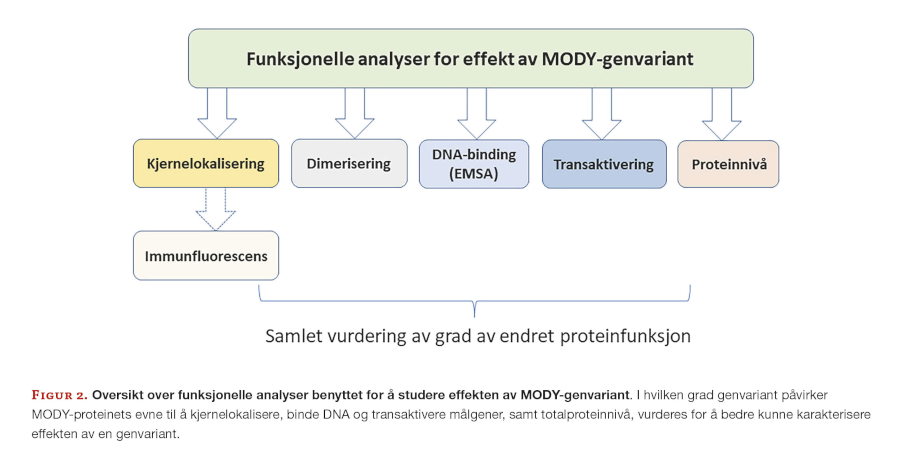
Tap av funksjon kan ofte sees i sammenheng med i hvilket proteindomene genvarianten sitter.
Utgangspunktet for slike funksjonelle analyser er at man inkorporerer (seterettet mutagenese) pasientens genvariant i et plasmid som inneholder det aktuelle MODY-genet sin cDNA-sekvens. Plasmidet føres så inn i en relevant cellelinje (transfeksjon), der cellens eget apparat sørger for at den modifiserte (muterte) transkripsjonsfaktoren blir produsert i cellen. Lysat fra slike celler utgjør da proteinmateriale for de funksjonelle analysene omtalt ovenfor (i-iv).
Cellelinjer som ofte benyttes i slike studier er linjer som tillater studier av modifisert protein alene (HeLa/HEK293 som selv ikke uttrykker de normale utgavene av transkripsjonsfaktorene), eller som tillater studier av en tilnærmet heterozygot tilstand (INS1/MIN-6/HepG2 som uttrykker de normale utgavene av transkripsjonsfaktorene).
Kjernelokalisering
De MODY-assosierte transkripsjonsfaktorene er kjerneproteiner og har sin hovedfunksjon i cellekjernen hvor de binder DNA. Hit blir de transportert etter proteinsyntesen. Kjerneproteiner har ofte innebygd et kjernelokaliseringssignal (NLS), som bidrar i reguleringen av deres import inn i kjernen (27). Selv om en genvariant ikke direkte sitter i et proteins NLS, kan den medføre en endring i proteinets tredimensjonale struktur, som indirekte rammer tilgjengeligheten av dette NLS-signalet. Dette vil kunne hindre at tilstrekkelig protein transporteres til kjernen.
En skreddersydd in vitro funksjonell analyse for å undersøke effekt av genvariant på kjernetransport består av at man fraksjonerer transfekterte celler og isolerer kjernefraksjonen fra cytosolfraksjonen (28). Deretter analyseres mengden av modifisert transkripsjonsfaktor ved bruk av immunologiske metoder, og man sammenligner nivå med umodifisert transkripsjonsfaktor (positiv kontroll). I slike metoder inngår proteinseparasjon ved hjelp av gelelektroforese (SDS-PAGE), og deteksjon av protein ved antistoff spesifikk mot transkripsjonsfaktoren. Interne kontroller som også benyttes er kjernefraksjon fra celler som uttrykker tomt plasmid (negativ kontroll), samt en kjent genvariant som ikke lar seg lokalisere i cellekjernen (29). Sistnevnte er viktige kontroller i samtlige funksjonelle analyser beskrevet under, for å kunne skalere omfanget av patogen effekt av en ny genvariant, basert på godt studerte varianter (25, 30) (Figur 3).
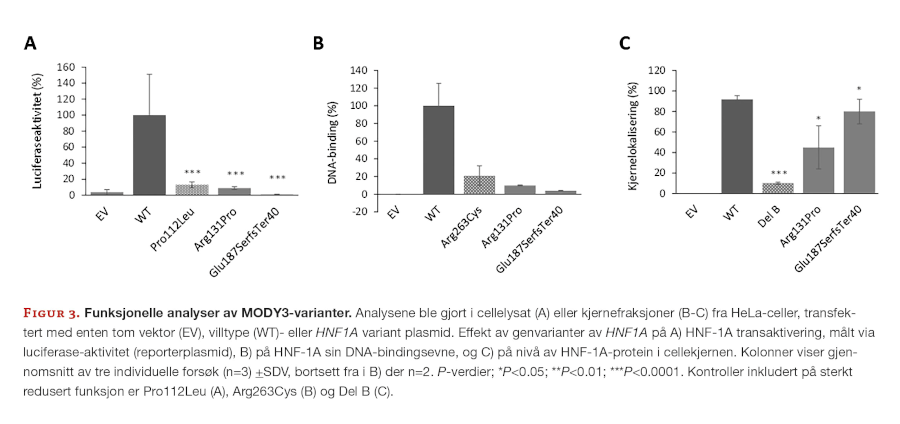
Som tilleggsanalyse kan immunfluoresensanalyser i intakte transfekterte celler supplere kjernefraksjonsanalysene, og gi mer detaljert informasjon om endring i styrke og lokalisering av modifisert transkripsjonsfaktor ved fluoresensmikroskopi (22).
Dimeriseringsevne
De MODY-assosierte transkripsjonsfaktorene utøver sin funksjon som dimerer. HNF-4A fungerer som en homodimer, det vil si at den interagerer med en kopi av «seg selv», mensHNF-1A og HNF-1B kan både fungere som homodimer, eller som heterodimer, med hverandre (HNF-1A/HNF-1B). Dimeriseringsevnen til modifisert transkripsjonsfaktor analyseres vanligvis ved gelelektroforese under ikke-denaturerende betingelser (nativ gel), der proteiner separeres ut ifra deres ladning, størrelse og native form. Her benyttes celleekstrakt (kjernefraksjon eller total cellefraksjon) fra transfekterte celler. Hvor sterkt komplekset (dimer) synes i gel, definerer hvor godt transkripsjonsfaktorene evner å dimerisere. Dimeriseringsevnen vurderes opp mot umodifisert transkripsjonsfaktor (positiv kontroll) og aktuelle patogene varianter kjent for å ha en dårlig dimeriseringsevne (31).
DNA-bindingsevne
De MODY-assosierte transkripsjonsfaktorene regulerer ekspresjon av målgener ved å binde spesifikke områder i promotorregionen til slike gener. I en funksjonell analyse for å vurdere effekt av genvariant på DNA-bindingsevnen til transkripsjonsfaktoren, benyttes kjernefraksjonen isolert fra transfekterte celler som uttrykker modifisert transkripsjonsfaktor. Et slikt prøvemateriale inkuberes deretter med en kjent, kort dobbeltrådig DNA-sekvens tilhørende promotorregionen til et aktuelt målgen (30, 32). Under normale omstendigheter skal det her dannes et kompleks mellom transkripsjonsfaktoren i kjernefraksjonen og den fluoresensmerkede dobbeltrådige DNA-sekvensen.
Komplekset (DNA-protein) analyseres ved ikke-denaturerende betingelser ved gelelektroforese. Omfang av binding vurderes ut ifra styrke/intensitet av komplekset, og sammenlignes med bindingsevne til umodifisert transkripsjonsfaktor (positiv kontroll). Andre interne kontroller som også benyttes i vurderingen, er patogene MODY-genvarianter som det er kjent at har en meget dårlig DNA-bindingsevne (Figur 3).
Transaktiveringsevne
De MODY-assosierte transkripsjonsfaktorenes evne til å regulere ekspresjon av målgener (transaktivere) blir vanligvis studert ved å benytte reporterplasmider, styrt under en promotor som det er kjent at transkripsjonsfaktoren binder. Slike reporterplasmider kan inneholde luciferase-gen, der omfang av transaktivering er proposjonal med mengde uttrykt luciferase. Dette måles etter plasmidtransfeksjon i relevante cellelinjer. For HNF-1A kan reporterplasmid inneholde promotor til genet GLUT2 eller HNF4A (P2-promotor), for HNF-4A inneholde CYP2D6 eller HNF1A, og for HNF-1B inneholde GLUT2.
Studier har vist at valg av cellelinje for analysen kan påvirke omfang av transaktivering (24, 30), da disse transkripsjonsfaktorene som oftest opererer i kompleks med andre kjente/ukjente kofaktorer, som bistår i regulering av transkripsjon av målgener (Figur 3).
Proteinnivå
Da genvarianter kan påvirke både genekspresjon og proteinstabilitet, er målinger av proteinnivå relevant å inkludere som funksjonell analyse. Effekt av MODY-genvariant på relativt nivå av protein uttrykt i en cellelinje inngår som en del av de funksjonelle analysene. Denne analysen, som baserer seg på gelelektroforese av proteiner og immunologisk deteksjon av protein via antistoff, har imidlertid vist seg å være utfordrende å tolke. Årsaken til dette har vært relativt store variasjoner ved western blot-analyser og mellom biologiske replikater.
Klinisk betydning
Å linke data fra de funksjonelle analysene med kliniske data, familiehistorie, tidligere rapporter fra litteraturen, og in silico-verktøy for predikering av genvarianteffekt, har vist seg viktig i den totale evalueringen av alvorlighetsgraden til genvarianter.
I en studie av 17 genvarianter i HNF1A-genet (MODY3) medførte dette en reklassifisering av så mange som 10 av 17 (69%) genvarianter (33). På bakgrunn av dette ble utvalgte MODY3-pasienter anbefalt endret behandling av sin diabetes (fra insulin > til sulfonylurea-derivater), med god klinisk respons. Pasienter med HNF1A varianten p. (Glu187SerfsTer40) (Figur 3) var blant disse.
Konklusjon
Funksjonelle analyser av MODY-genvarianter er vesentlig i utredningen av genvarianters alvorlighetsgrad. Forfatterne av artikkelen har hatt ansvaret for å etablere slike funksjonelle analyser ved forskningslaboratoriet ved Universitetet i Bergen (Klinisk institutt 2), og ved Bioingeniørutdanningen ved Høgskulen på Vestlandet. Den genetiske evalueringen av MODY-varianter har vært gjort ved Avdeling for medisinsk genetikk, Haukeland universitetssjukehus.
Denne artikkelen belyser viktigheten av slike analyser for «å forstå» hvilken konsekvens en genvariant har på MODY-transkripsjonsfaktorer sin normale funksjon i kroppens signalveier for insulinsekresjon, og som en mulig forklaring på underliggende molekylære mekanismer bak monogen diabetes som MODY. Dette er viktig både med hensyn til ACMG sine anbefalinger om funksjonell MODY-diagnostikk, muligheter for endret behandling av visse MODY-subtyper, og av hensyn til globale forskningssamarbeid rundt MODY.