Innledning
Beinmineraltetthet (BMD) er en viktig prediktor for frakturrisiko, men én enkelt måling indikerer bare beintettheten ved det gitte tidspunktet, og ikke hastigheten av forventet beintap. Gode biokjemiske markører som kan benyttes for å følge utvikling av beintap hos den enkelte pasient, er derfor gunstig. Denne artikkelen tar for seg bakgrunnen og mekanismen for osteoporose, gir et kort sammendrag av dagens behandling og risikofaktorer, samt en gjennomgang av de tilgjengelige biokjemiske markørene for beinomsetning.
Materiale og metode
Artikkelen er basert på gjennomgang av artikler funnet ved søk på PubMed med søkeordene ”osteoporosis” og ”bone markers”, samt forfatternes egne erfaringer fra arbeid med beinmetabolisme både fra basalforskning, klinisk forskning og i klinikk.
Osteoporose
Osteoporose er en kronisk, progressiv skjelettsykdom karakterisert av lav beintetthet og forringet mikroarkitektur i beinvevet, noe som medfører nedsatt knokkelstyrke og økt risiko for frakturer (1). Dette er den vanligste metabolske skjelettlidelsen i vesten, med høyest prevalens i skandinaviske land (2). I følge en rapport fra verdens helseorganisasjon (WHO), har omtrent 40 % av alle hvite postmenopausale kvinner osteoporose, og denne sykdommen medfører over 4,5 millioner brudd per år hos den totale befolkningen i Europa og USA. Hoftebrudd er den mest alvorlige konsekvensen av osteoporose, og medfører langvarige sykehusopphold, nedsatt funksjonsevne og økt mortalitet (3). Norge ligger på verdenstoppen i antall hoftebrudd, og i følge Folkehelseinstituttet skjer det cirka 9000 hoftebrudd per år i Norge (ett per time året rundt), hvorav 70 % prosent av bruddene rammer kvinner. Selv om ikke alle hoftebrudd skyldes osteoporose, er dette hovedårsaken. Det anslås at omtrent 240 000 nordmenn lider av osteoporose (4).
Osteoporose er en underdiagnostisert og underbehandlet sykdom, og på grunn av at den har et stille forløp uten fremtredende symptomer, blir den oftest oppdaget på grunn av lavenergifrakturer i håndledd, ryggvirvel eller hofte (5).
Osteoporose diagnostiseres vanligst ved måling av beinmineraltetthet (BMD) ved bruk av røntgenabsorpsjonsmetri (”dual-energy x-ray absorptiometry”, DXA). Ved DXA rettes to røntgenstråler med ulik energi mot området som skal måles, og arealtettheten av beinmineral (hydroxyapatitt) og mykvev i det undersøkte området utledes. Stråledosen er omtrent 1/10 av en vanlig røntgen thorax. Osteopeni defineres som en T-skår mellom -1 og -2,5, hvor T-skår korresponderer til antall standardavvik (SD) under gjennomsnittlig BMD hos unge voksne, mens osteoporose defineres som T-skår under -2,5 (6). Etablert osteoporose foreligger ved T-skår under -2,5 kombinert med en lavenergifraktur.
Skjelettet
Skjelettet består av ulike vevstyper og fungerer som et reisverk for kroppen, gir beskyttelse og feste for organer, overfører muskelkontraksjoner til bevegelse og er kroppens lager for kalsium, fosfor og magnesium. Beinmargen er i tillegg primærsetet for produksjon og utvikling av blodceller (hematopoesen).
Beinvev består av kortikalt (tett) og trabekulært (spongiøst) bein, som er ulike i arkitektur, men like i molekylær sammensetning.
Skjelettet er dynamisk og beinvev dannes og fjernes (resorpsjon) i en prosess kalt remodellering. Ved beinmodellering er beinformasjonen større enn resorpsjonen, noe som er tilfelle frem til maksimal beintetthet oppnås rundt 25 - 30-årsalderen. Remodellering refererer til en likevekt mellom formasjon og resorpsjon, hvor gammelt beinvev erstattes av nytt med en hastighet på 25 % per år i trabekulært bein og 3 % i kortikalt beinvev, noe som medfører at alt beinvev i skjelettet byttes ut omtrent hvert tiende år etter at maksimal beintetthet er oppnådd (7).
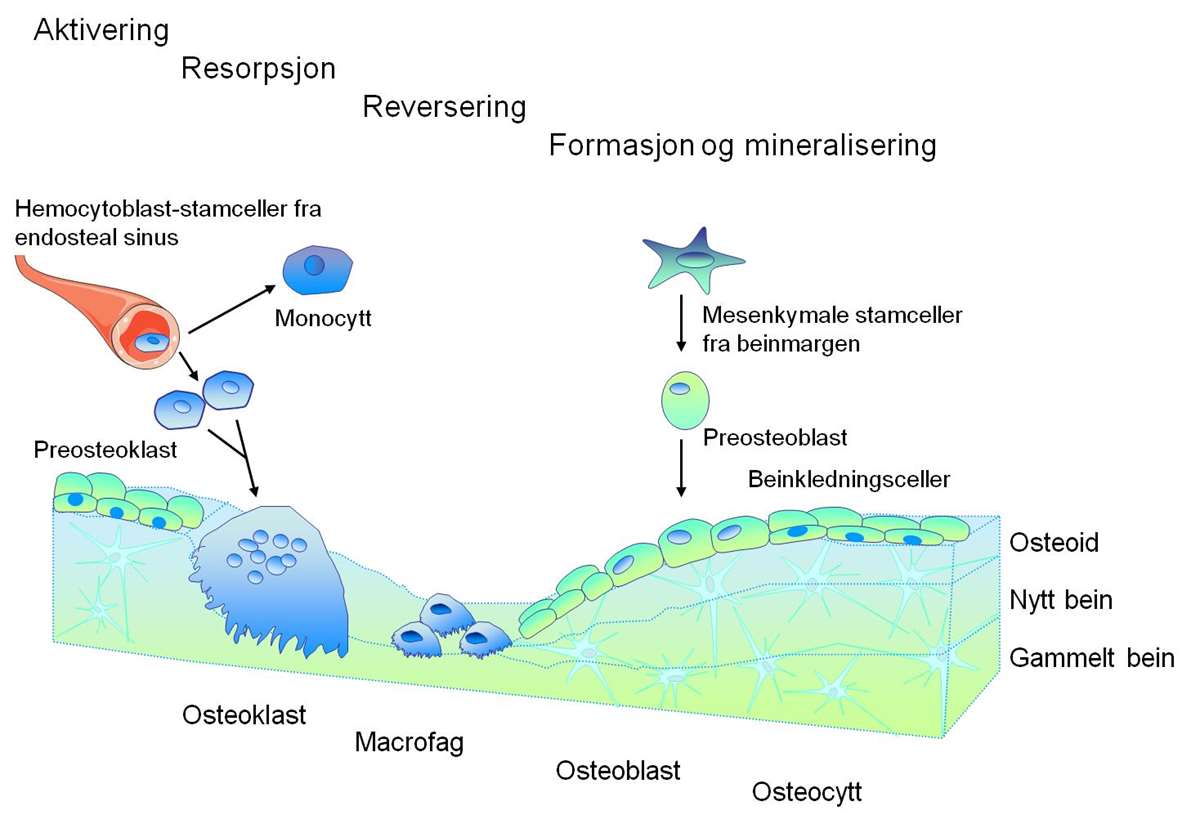
De to hovedtypene av celler i beinvev er de beindannende osteoblastene og beinnedbrytende osteoklastene. Sammen med osteocyttene, som er celler inkorporert i beinvevet, danner disse en enhet (”basic multicellular unit”, BMU), hvor remodelleringen foregår (7) (figur 1). Nøye regulering av denne prosessen er helt essensiell for homeostase i beinvevet. Ved osteoporose er denne likevekten forskjøvet, slik at mer bein brytes ned enn det dannes.
Osteoblastceller stammer fra mesenkymale stamceller (MSC) i beinmargen. Disse stamcellene gir i tillegg opphav til en rekke andre celletyper som adipocytter (fettceller), myoblaster (forløpere til muskelceller) og fibroblaster (forløpere til bindevevsceller). Osteoblaster er ansvarlige for produksjon av hovedkomponentene i den organiske beinmatriksen (osteoid), og for sedimentering og mineralisering av ekstracellulær beinmatriks. Det er fire ulike modningsstadier av denne celletypen; preosteoblaster, osteoblaster, osteocytter og beinkledningsceller. Preosteoblaster modnes til osteoblaster som aktivt danner bein. En moden osteoblastcelle karakteriseres av sin evne til å syntetisere spesifikke proteiner, og har et høyt nivå av alkalisk fosfatase (ALP), som er viktig i beinmineraliseringsprosessen (8). Etter at beinvevet er dannet, blir en andel av osteoblastcellene (10 - 20 %) inkorporert i den nydannede beinmatriksen og omdannes til osteocytter. Osteocytter kommuniserer med hverandre og med osteoblaster på overflaten av beinvevet, via lange utløpere som går i kanaler gjennom beinmatriksen (9).
Osteoklaster stammer fra hemotopoetiske stamceller i beinmargen som også er opphav til monocytter og makrofager. Aktive, modne osteoklaster er ansvarlige for nedbryting av både organisk og uorganisk beinmatriks (10). En moden osteoklast dannes ved sammensmeltning av mononukleære preosteoklaster til en stor celle med flere kjerner (opp til 100), vakuoler og lysosomer. Nedbryting av bein foregår ved at osteoklaster binder seg til deler av beinmatriksen og frigjør hydrogenioner slik at pH senkes. Dette medfører at den uorganiske andelen av beinmatriksen løses opp. Den organiske delen av beinmatriksen blir deretter oppløst av protolytiske enzymer. Denne prosessen resulterer i at det dannes groper i beinmatriksen (Howships lakuner).
Den ekstracellulære beinmatriksen består av 65 % uorganisk materiale som dannes ved avleiring og mineralisering av salter, hovedsakelig i form av krystallinsk trikalsiumfosfat hydroksyapatitt (Ca5(PO4)3(OH)). De organiske komponentene i beinmatriksen består hovedsakelig av type 1 kollagenfibre, osteokalsin, osteonektin, glykoproteiner og proteoglykaner. Osteokalsin er et beinspesifikt, vitamin K-avhengig protein som dannes av osteoblaster og utsondres til blodomløpet.
Det er som nevnt svært viktig med nøye regulering av remodelleringsprosessen. Enhver forstyrrelse i likevekten mellom resorpsjon og formasjon av bein vil medføre en patologisk tilstand i skjelettet. Regulering av remodelleringen foregår både systemisk og lokalt. De viktigste systemiske regulatorene er parathyroideahormon (PTH), calcitriol (vitamin 1,25 D3) og kjønnshormoner. Lokal regulering involverer en rekke cytokiner og vekstfaktorer, og via det, lokale reseptoraktivator av nukleær faktor κB ligand (RANKL)/RANK/osteoprotegerin (OPG)-systemet, er resorpsjon og formasjon tett koblet. RANKL utskilles av blant annet osteoblaster og binder seg til reseptoren RANK på osteoklastforløpere og osteoklaster, og er en essensiell faktor for rekruttering, differensiering og funksjon av disse cellene, noe som til syvende og sist medfører økt resorpsjon. Binding av RANKL til det kompetitive proteinet OPG, hindrer binding til RANK, og stopper dermed rekruttering og aktivitet av osteoklaster.
I og med at osteoblastene bruker flere måneder på å danne den mengden bein som osteoklastene har brutt ned på bare noen uker, vil alle endringer som medfører en økt remodelleringshastighet (som for eksempel aldring og bortfall av østrogen etter menopausen), på sikt gi økt netto beintap (11).
Risikofaktorer
Selv om osteoporose defineres ut fra beintetthet, er lav BMD kun en av flere faktorer som tilsier at man har økt risiko for brudd. Risikoen for å få osteoporose er sterkt avhengig av genetikk, og studier viser at spesielt hoftebrudd er sterkt arvelig, og til dels uavhengig av BMD (12). Kjønn og etnisitet er viktige prediktorer for osteoporose, og kaukasiske kvinner (hvite kvinner i Europa og Nord-Amerika) er mer utsatt. Tidlig menopause vil forsterke denne risikoen på grunn av østrogenbortfall. Det skjer et gradvis fall i BMD fra man er 30 år, og høy alder er derfor også en risikofaktor.
Mekanisk belastning på skjelettet som følge av ytre påvirkning som gravitasjon og/eller fra muskelkontraksjoner, er viktig for stimulering av beindannelse (13). Fravær av mekanisk belastning kan indusere alvorlig beintap, men det kan til dels reverseres ved trening (14). Anabolske signaler eller anti-resorpsjonssignaler fra mekanisk belastning medieres via osteocytter, som fungerer som mekanosensorer i beinvevet (15). Optimalisering av maksimal beintetthet ved hjelp av trening i ungdomstiden ansees som en viktig faktor for å forebygge osteoporose senere i livet (16).
Livsstilsfaktorer som høyt alkoholforbruk, røyking, inaktivitet og manglende inntak av kalsium og vitamin D, virker også i stor grad negativt på skjelettmetabolismen. I tillegg er lav kroppsvekt (som for eksempel ved anorexia nevrosa) en betydelig risikofaktor for brudd og osteoporose (17).
Noen medikamenter kan medføre sekundær osteoporose, spesielt vil langvarig bruk av glukokortikoider gi redusert beintetthet og beinkvalitet (18). Sekundær osteoporose kan også inntre som følge av en rekke sykdommer, som hyperkortisolisme (økt utskillelse av kortisol fra binyrebarken), hyperparatyreoidisme (økt utskillelse av PTH fra biskjoldbruskkjertlene) og hypertyreose (høyt stoffskifte på grunn av økt tyroksinproduksjon i skjoldbruskkjertelen).
Behandling
Antiresorptive medikamenter i kombinasjon med tilskudd av kalsium og vitamin D, benyttes for å redusere risikoen for brudd hos personer med osteoporose (19). De vanligste medikamentene i klinisk bruk i dag er bisfosfonater og denosumab. Hormonsubstitusjon (østrogen/gestagen) og raloxifene, som er en selektiv østrogenreseptormodulator (SERM), er også behandlingsalternativer. Perorale bisfosfonater er førstevalg ved behandling av osteoporose (20), mens intravenøse bisfosfonater (en gang per år) anvendes hvis pasientene får gastrointestinale bivirkninger. Bisfosfonater er en gruppe kjemisk stabile analoger av pyrofosfat, som hemmer resorpsjon av bein ved at de absorberes til overflaten av mineralisert vev og interagerer med osteoklaster (21). Denosumab er et monoklonalt antistoff mot humant RANKL, som nylig har kommet på markedet (20). Både bisfosfonater og denosumab gir en effektiv bruddreduksjon (50 - 70 % reduksjon i relativ risiko) av vertebrale brudd og cirka 50 % reduksjon av hoftebrudd (22, 23).
Det eneste preparatet på markedet i dag som virker ved å stimulere beinformasjon fremfor hemning av resorpsjon, er intermitterende behandling med PTH-analoger (24). Dette gis som subkutan injeksjon en gang daglig i to år. Intermitterende administrering virker anabolt på beinvev, mens kontinuerlig forhøyet PTH, som ved primær hyperparatyreoidisme, fører til en katabolsk tilstand med økt nedbryting av bein (25). På grunn av høy pris er dette en behandling som forbeholdes de dårligste osteoporosepasientene.
Forebygging av osteoporose
Tilstrekkelige nivåer av vitamin D er viktig for kalsiumopptak og beinmetabolisme, i tillegg til å gi gunstige effekter på blant annet immunsystemet og regulering av blodtrykk. Den viktigste kilden til vitamin D er egenproduksjon i huden når vi utsettes for ultrafiolett stråling (hovedsakelig sollys). Spesielt i vinterhalvåret får vi i Norge for lite vitamin D, og det er derfor viktig å sikre nok inntak gjennom kost og/eller kosttilskudd. Et kosthold som sikrer nok inntak av kalsium og forhindrer undervekt, er også viktige for å forebygge osteoporose.
For unge er det spesielt viktig med riktig kosthold og nok fysisk aktivitet for å sikre optimal beintetthet. Fysisk aktivitet, og da særlig vektbærende aktivitet, har en positiv effekt på skjelettet hos voksne og eldre. Selv moderat fysisk aktivitet har vist å gi gunstig effekt. Trening gir foruten en direkte effekt på skjelettet, også økt muskelstyrke, noe som vil virke fallforebyggende, og dermed reduserer risikoen for frakturer. For mer informasjon anbefales ”Faglige retningslinjer for forebygging og behandling av osteoporose og osteoporotiske brudd”, utgitt av Helsedirektoratet.
Beinmarkører
Kvantifisering av enzymer eller proteiner som frigjøres til blod eller urin under dannelse eller nedbryting av bein, kan gi et sensitivt og spesifikt bilde på remodelleringen som foregår i skjelettet (26). Nye metoder for biokjemiske målinger av beinomsetning har blitt utviklet de siste tiårene. Disse markørene er ikke anbefalt for diagnostisering av osteoporose, men er nyttige for dosetilpasning av medikamenter og monitorering av osteoporosepasienter under behandling (26). Disse beinmarkørene kan også være nyttige for å bestemme mulig årsaker for sekundær osteoporose ved identifisering av pasienter med høy beinomsetning og hurtig beintap (27).
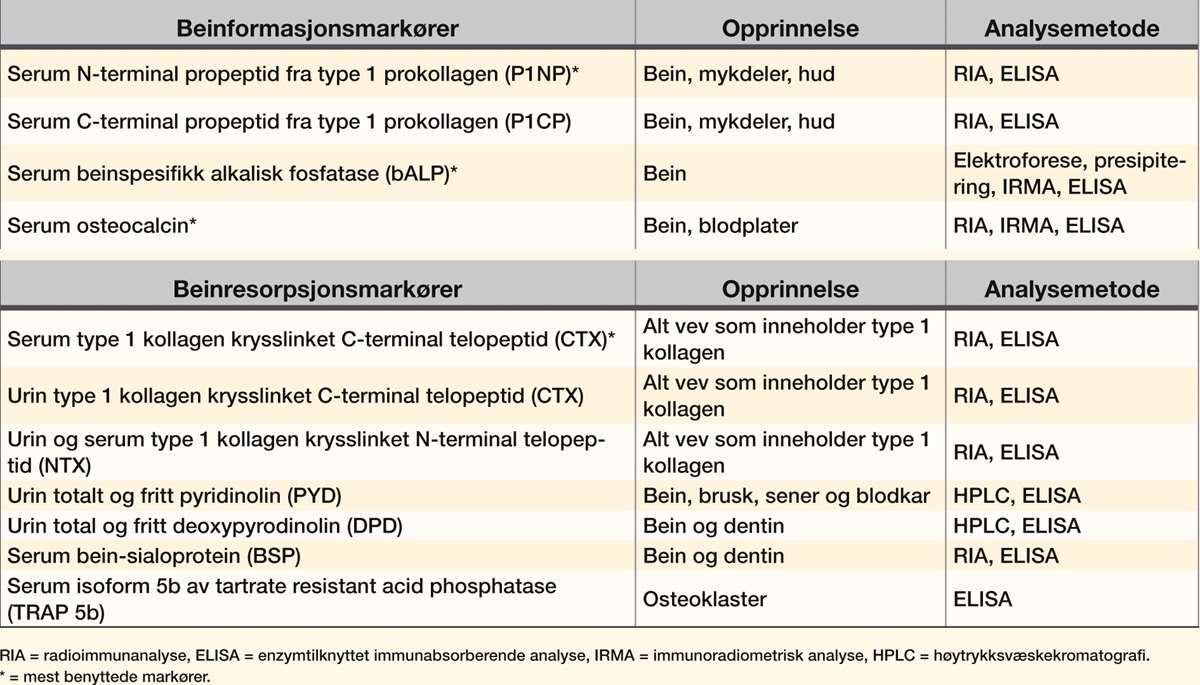
Markører for beinmetabolisme kan måles i serum eller urin, og deles inn i markører for formasjon og beinresorpsjon (tabell 1).
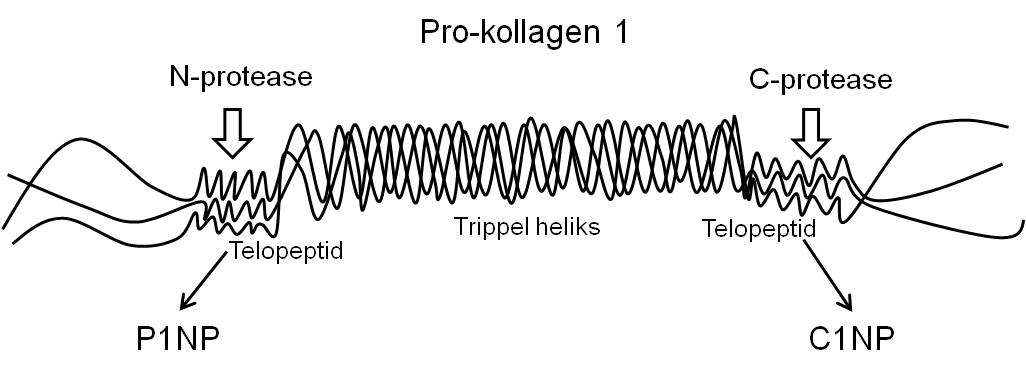
Prokollagen type 1 inneholder N- og C-terminalforlengelser som spaltes og frigjøres til blodet ved hjelp av spesifikke proteaser under den ekstracellulære dannelsen av kollagen (figur 2). Disse forlengelsene er N- og C-terminal propeptider fra type 1 prokollagen (P1NP og P1CP), og er spesifikke for prolifererende osteoblaster og fibroblaster. Antistoffene Anti-P1NP og anti-P1CP benyttes for deteksjon ved bruk av RIA eller ELISA, hvorav P1NP-målinger er den mest sensitive og benyttede metoden.
Serum alkalisk fosfatase (ALP) finnes i mange isoformer, og kan stamme fra flere ulike vevstyper (hovedsakelig bein og lever). Beinspesifikk ALP (bALP) er et enzym som er lokalisert på overflaten av osteoblaster og regulerer mineraliseringen av beinmatriks ved å spalte organisk fosfat og pyrofosfat til uorganisk ortofosfat, som er substrat for syntesen av hydroxyapatitt (28). Det er nå utviklet monoklonale antistoffer mot bALP, som gjør denne markøren mer sensitiv som en markør for mineralisering.
Osteocalcin er et vitamin K-avhengig protein som syntetiseres av osteoblaster. Osteocalcin inngår i beinmatriksen, men deler av proteinet utskilles til blodet under beinformasjonen. Deler av proteinet vil også skilles ut ved beinresorpsjon, og er derfor også et mål på økt beinomsetning (29).
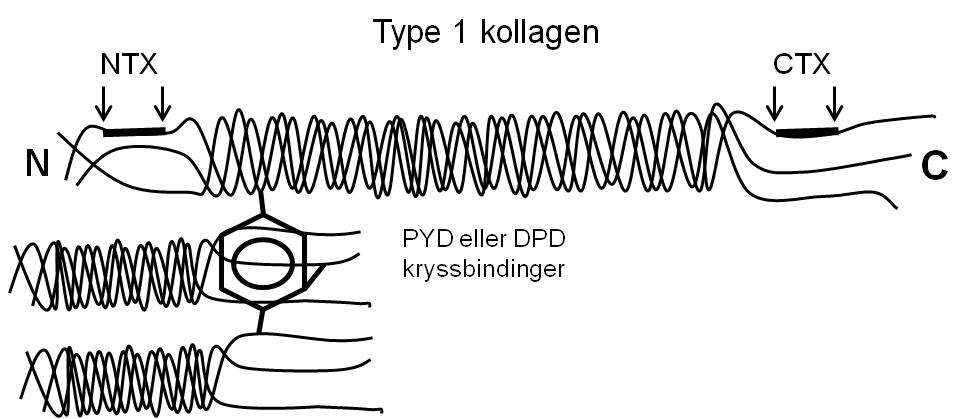
De fleste markører for beinresorpsjon er basert på degraderingsprodukter fra hydrolytisk nedbrytning av kollagen 1. Kollagen 1 utgjør 90 % av alt protein i bein, og er krysslinket med pyrodinolin (PYD) og deoxypyrodinolin (DPD) (figur 3), som frigjøres ved degradering av modent kollagen 1. DPD finnes, i motsetning til PYD, kun i bein og dentin. Forholdet mellom PYD til DPD i urin er lik forholdet mellom disse kryssbindingene i bein, og de frie formene (60 % av både PYD og DPD er peptidbundet) kan detekteres ved immunoassay, mens total PYD og DPD detekteres ved hjelp av HPLC.
Metoder for å detektere serum og urin type 1 kollagen krysslinket C-eller N-terminal telopeptid (CTX og NTX), benytter antistoff mot isolerte kollagenpeptider som inneholder kryssbindinger, i stedet for å detektere selve kryssbindingene (figur 3). Metoden er mest utviklet for CTX, som i dag er den mest benyttede resorpsjonsmarkøren. CTX forekommer i to isoformer (α og β), og kun β-formen kan detekteres i serum. Markører som detekterer kollagen kryssbindinger og kollagen telopeptider har en døgnvariasjon på 10 - 20 % og nivåene er også sensitive for matinntak som medfører redusert beinresorpsjon. Det er derfor svært viktig at målinger blir utført etter en natts faste (30).
Bein-sialoprotein (BSP) og isoform 5b av tartrate resistant acid phosphatase (TRAP 5b) i serum er to mulige resorpsjonsmarkører som ikke baserer seg på degradering av kollagen 1. BSP er et protein med høy affinitet for hydroxyapatitt og er involvert i mineralisering av beinmatriks og kalsifisering av vev. Målemetoder for BSP i serum er foreløpig basert på polyklonale antistoff, og det er uklart hvorvidt BSP kan være en sensitiv markør for beinremodellering, men det antas at serum BSP hovedsakelig reflekterer beinresorpsjon (31). TRAP 5b er et osteoklastspesifikt enzym, og serum TRAP 5b kan derfor være en god markør for beinresorpsjon. Utvikling av assay for deteksjon av TRAP 5b med spesifikke antistoff, er under utvikling (30).
Nylig ble det foreslått av et utvalg satt sammen av eksperter fra den internasjonale osteoporoseforeningen (IOF) og det internasjonale forbundet for klinisk kjemi og laboratoriemedisin (IFCC), at serumkonsentrasjoner av P1NP og CTX skal være referansemarkører for henholdsvis beinformasjon og beinresorpsjon (32). CTX og P1NP ansees som de beste markørene fordi de er best karakterisert, gir best spesifisitet og er mest reproduserbar i kliniske studier (32). Analysemetodene er lett tilgjengelige og gjennomførbare, og gir små inter- og intraassay variasjoner. Det er også gode muligheter for standardisering av disse metodene i rutinelaboratorier.
For osteoporosepasienter anbefales serumanalyser ved oppstart av behandling, og deretter minimum etter tre og seks måneder for resorpsjonsmarkør, og seks måneder etter behandlingsstart for formasjonsmarkør. Alle blodprøver må tas om morgenen etter en natts faste.
Konklusjon
Norge har den høyeste forekomst av osteoporotiske brudd i verden. Osteoporose er underdiagnostisert og underbehandlet til tross for gode diagnostiske metoder (DXA) og effektiv behandling. Det er utviklet en rekke biokjemiske beinmarkører som kan benyttes for å følge utviklingen av beinmetabolisme og som er nyttige i oppfølgning av behandling. P1NP er den beste markør for beinformasjon, mens CTX er den beste for beinresorpsjon. Mer forskning gjenstår for å bestemme hvilke av disse markørene som er mest spesifikke og sensitive for deteksjon og monitorering av osteoporose og eventuelt andre beinsykdommer. Det er også behov for kontinuerlig vurdering av hvilke markører man skal benytte som referansemarkører, samt å bestemme standardiserte målemetoder og referanseverdier for disse.