Hovedbudskap
- For å skille mellom trombocytopeni og pseudotrombocytopeni må prøven undersøkes for trombocyttaggregater.
- Vi har sammenliknet vår standardmetode, blodutstryk, med direkte mikroskopi av fullblodsdråpe og buffycoat.
- Vi anbefaler buffycoat som alternativ metode til blodutstryk ved vurdering av trombocyttaggregater fordi den har god sensitivitet, er enkel å utføre og er tidsbesparende.
Innledning
Trombocytter (blodplater) produseres i benmargen og er fragmenter av megakaryocyttenes cytoplasma. Megakaryocytters opphav, megakaryoblaster, dannes ved differensiering av hematopoietiske stamceller. Én megakaryocytt kan gi opphav til 1000 – 5000 trombocytter. Trombocytter er omtrent 20 % av størrelsen til erytrocytter, med et volum på 7 – 19 fL og diameter på 2 – 4 μm (1, 2). Trombocytter sirkulerer i blodbanen i syv til 10 dager (2).
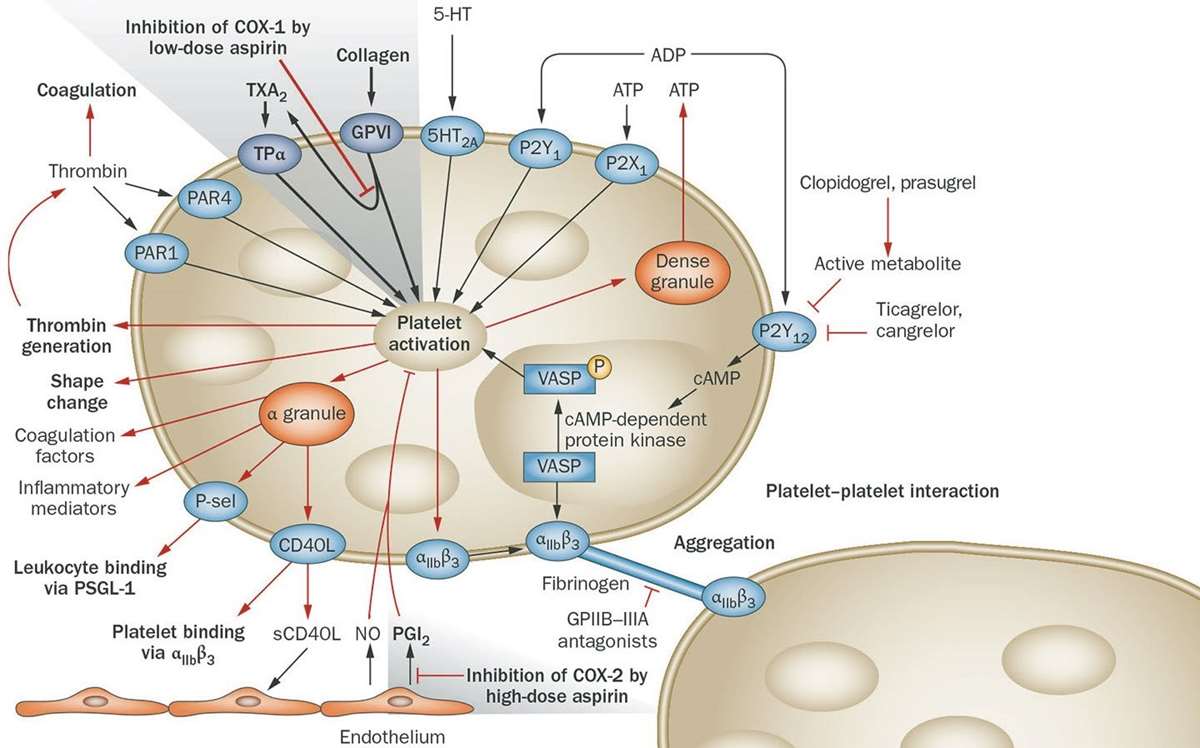
De har ikke kjerne, men har mange unike strukturer som er essensielle for at de kan utøve sin funksjon. Trombocyttmembranen består blant annet av forskjellige glykoproteiner (GP) som fungerer som reseptorer, hvor reseptor for von Willebrands faktor (VWF) spiller en viktig rolle. GP medvirker i to av trombocyttenes viktigste funksjoner: adhesjon til subendotelt vev (kollagen) og aggregering med andre trombocytter (3, 4). Stimulering av trombocytter fører til aktivering av GPIIb/IIIa-molekyler. Figur 1 viser hvordan trombocyttene kryssbindes med fibrinogenbroer (5). Denne bindingen fører til molekylær konformasjonsendring som resulterer i en sterk kobling og videre aktivering av trombocytter. En hvilende trombocytt kan ha 50 – 80 000 passive GPIIb/IIIa-reseptorer.
ARTIKKELEN FORTSETTER UNDER FIGUREN
Trombocytopeni
Trombocytopeni (TCP) er unormalt lav konsentrasjon av trombocytter i blodet, og fører til redusert blødningskontroll. Det finnes ulike årsaker til TCP; medikamenter som påvirker funksjonen av benmargceller, heparinindusert trombocytopeni (6), lav produksjon av trombocytter på grunn av leukemi, økt nedbrytning av trombocytter i vev eller milt ved autoimmune sykdommer, store blødninger og spontan dannelse av koagel (7). TCP er også vanlig ved myelodysplastisk syndrom (MDS), hvor lave trombocytter skyldes manglende differensiering av megakaryocyttprogenitorceller og økt apoptose av megakaryocytter (8).
Pseudotrombocytopeni (PTCP) er falske lave verdier ved analysering av trombocytter og skyldes aggregering av blodplater in vitro. Dette kan mistolkes som reell TCP, og føre til feildiagnostisering og unødvendig behandling. PTCP er vanligvis forårsaket av EDTA, og skyldes konformasjonsendringer i de cytoadhesive GPIIb-IIIa-reseptorene i trombocyttmembranen. Det skjer en eksponering av epitoper som blir tilgjengelige for autoantistoffer, som igjen trigger trombocyttaggregering in vitro. IgG er det dominerende antistoffet, og vil i denne prosessen oppføre seg som kuldeagglutinin som reagerer med trombocyttene in vitro (9, 10, 11). PTCP kan også skyldes heparin in vitro (12). PTCP er vist å ha en prevalens på 0,1 – 2 % hos innlagte pasienter, og 15 – 17 % hos pasienter som evalueres isolert for TCP (13). Det er viktig å bekrefte eller avkrefte om lave trombocyttall skyldes TCP eller PTCP.
Påvisning av trombocyttaggregater
Ved Diakonhjemmet Sykehus analyseres hematologiske prøver med Sysmex XE-5000. Trombocytter måles enten ved hjelp av motstandsprinsippet (impedans) eller optisk ved flowcytometri (14, 15). I impedansekanalen analyseres trombocytter parallelt med erytrocytter, og separeres fra disse ut fra størrelse. Sysmex XE-5000 gir to trombocyttrelaterte flagg der aggregater kan være til stede i prøven: abnormal platelet distribution flag (PAD) og platelet clumps (CLP). Samsvar mellom flagging på instrumentet og forekomst av trombocyttaggregater har blitt undersøkt (16). Det ble vist at CLP er et mer pålitelig flagg med sensitivitet på 57 % (PAD 42 %), spesifisitet 99 % (PAD 83 %), positiv prediktiv verdi (PPV) på 37 % (PAD 1 %). Ved fravær av begge flagg er negativ prediktiv verdi (NPV) 100 %.
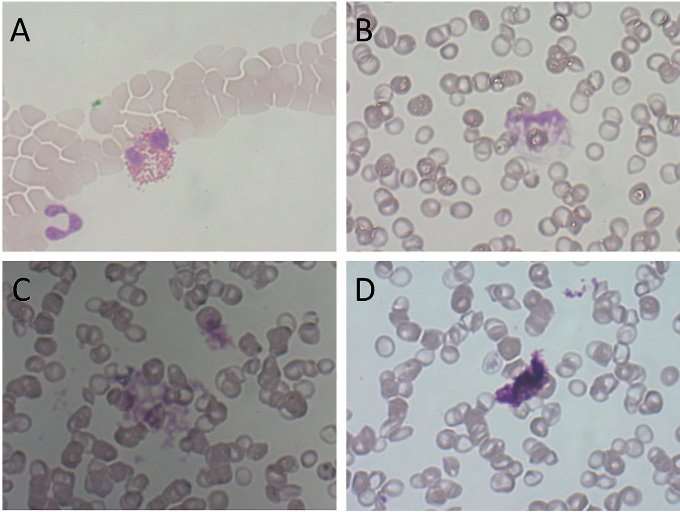
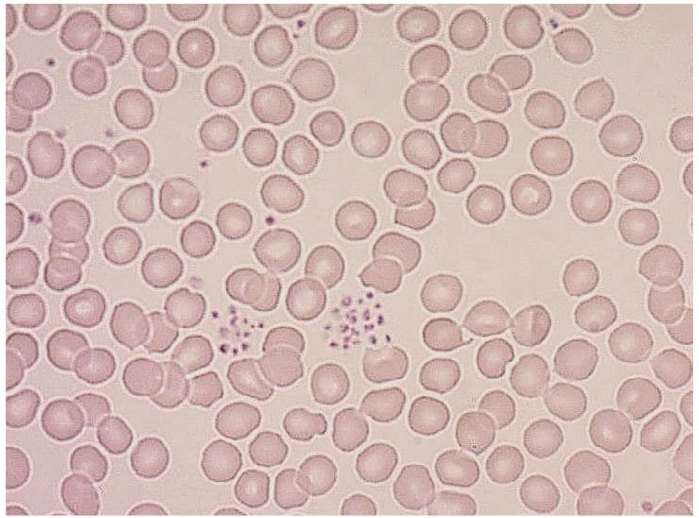
Ved uventet funn av trombocytopeni er gjeldende rutine ved Diakonhjemmet Sykehus at prøven undersøkes for trombocyttaggregater i blodutstryk. Dette er en ressurskrevende metode med utfordringer knyttet til subjektiv vurdering. Artefakter kan mistolkes som trombocyttaggregater (figur 2).
Mulige alternative metoder er bruk av buffycoat eller fullblodsdråpe til direkte mikroskopi. Fullblodsdråpe gir et tykt lag med erytrocytter som kan skjule trombocyttaggregater i prøven. Ved bruk av buffycoat er det usikkert om uttak av et lite volum vil påvirke antall leukocytter og trombocytter i så stor grad at prøverøret ikke kan benyttes til eventuell etterrekvirering.
Hensikten med denne studien var å sammenlikne referansemetoden (blodutstryk) med mikroskopi av buffycoat og fullblodsdråpe for påvisning av trombocyttaggregater med hensyn til sensitivitet, tidsbruk og utførelse. I tillegg ble det vurdert om uttak av buffycoat påvirker trombocytt- og leukocyttparametre ved reanalysering på Sysmex XE-5000.
Materiale og metoder
Studien gjelder kvalitetssikring av metode, og det kreves derfor ikke godkjenning fra Regional komite for medisinsk og helsefaglig forskningsetikk (REK).
Studiedesign
Det ble samlet inn til sammen 57 prøver fra både inneliggende og polikliniske pasienter med trombocyttverdier < 90 x 109/L. Blodprøvene var tappet på EDTA-rør og ble analysert på Sysmex XE-5000 (Sysmex Corporation, Kobe, Japan) for følgende parametere: Complete Blood Count (CBC) inkludert trombocytter, 5-parts differensialtelling av leukocytter (DIFF), kjerneholdige erytrocytter (NRBC) og retikulocytter.
Blodutstryk ble laget og farget med May-Grünwald/Giemsa-farging. Før vurdering i mikroskop påføres utstryket et tynt lag immersjonsolje. Utstryket vurderes først med 10x objektiv for å sjekke om fargingen har vært vellykket. For å kunne identifisere trombocytter og eventuelle aggregater ble hele utstryket vurdert med 40x objektiv (figur 3). Avdelingens kriterier for positivt funn i blodutstryk er minimum fire aggregater bestående av minst fire trombocytter.
Buffycoatpreparat ble laget ved å la EDTA-glasset stå på benk i cirka 20 minutter, slik at cellene sedimenterer. Leukocytter og trombocytter befinner seg i buffycoat, sjiktet i overgangen mellom erytrocytter og plasma. Det ble avpipettert 10 μL buffycoat cirka midt i buffycoatlaget. Det ble plassert på et objektglass og dekket med dekkglass. Buffycoatpreparatet ble mikroskopert i løpet av fem minutter for å unngå uttørking. Det ble først mikroskopert med 10x objektiv. For å bekrefte funn av aggregater ble det brukt 40x objektiv (figur 4). Prøven ble regnet som positiv ved synlige aggregater til stede i preparatet. Etter uttak av buffycoat ble prøven reanalysert på Sysmex XE-5000.
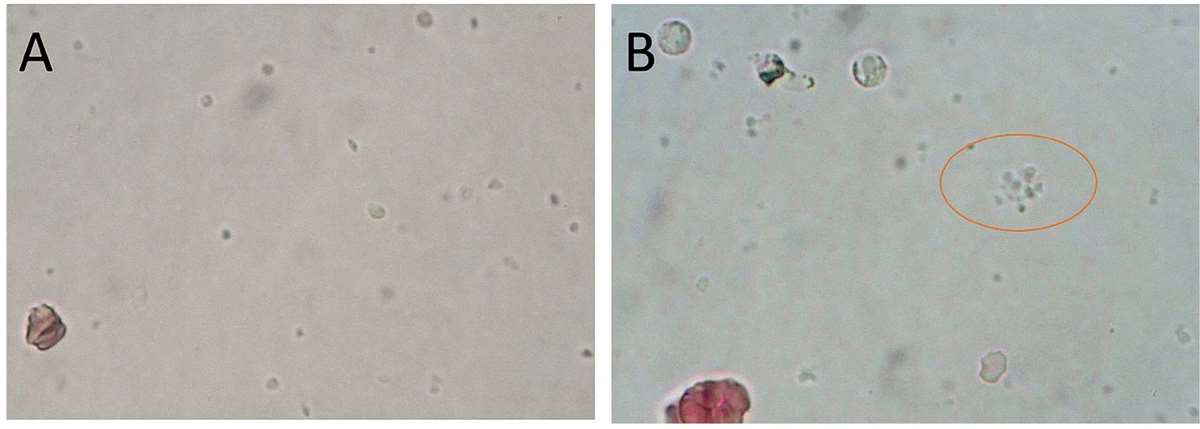
Tillaging av preparat for fullblodsdråpe ble utført ved at 10 μL fullblod ble plassert på et objektglass, og dekket med dekkglass. Fullblodsdråpen ble mikroskopert i løpet av fem minutter for å unngå uttørking. Mikroskopering ble utført med 40x objektiv (figur 5), og hele fullblodspreparatet ble undersøkt for trombocyttaggregater. Kriteriet om minst fire trombocytter i minst fire aggregater ble benyttet for å kategorisere prøven som positiv.
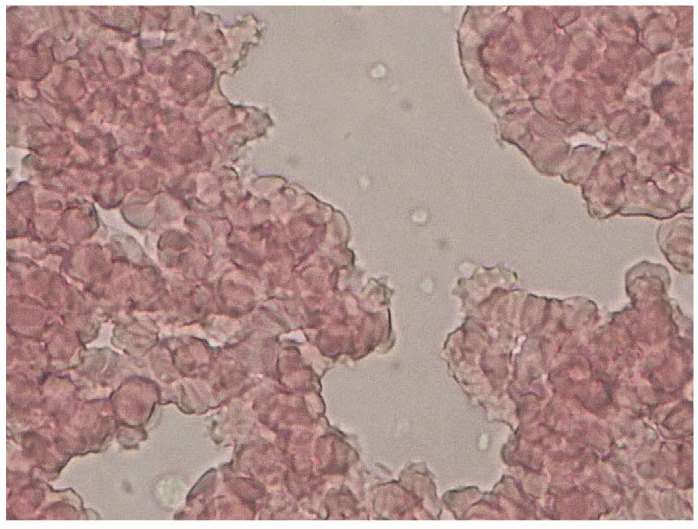
Funn av aggregater i blodutstryk var ikke kjent ved analysering av buffycoat og fullblodsdråpe.
Resultatene fra de to alternative metodene buffycoat og fullblodsdråpe ble sammenlignet med resultatet fra blodutstryk ved å sette opp krysstabeller og beregne sensitivitet. Sensitivitet beregnes ved formelen: antall sanne positive / (antall sanne positive + antall sanne negative).
Statistikk
Shapiro-Wilk normalfordelingsstest ble utført på differansen før og etter uttak av buffycoat for hver parameter analysert på Sysmex XE-5000. Grubbs test ble benyttet for beregning av eventuelle slengere, som i etterkant ble utelatt fra statistikken. Korrelasjonen mellom før og etter uttak av buffycoat ble beregnet med paret t-test for normalfordelte differanser, og Wilcoxon rangeringstest for ikke-normalfordelte differanser. Statistiske analyser ble utført med Microsoft Excel 2013 eller Analyse-it.
Resultater
Blodutstryk av de 57 prøvene med trombocyttverdier < 90 x 109/L, viste at 21 av prøvene var negative for trombocyttaggregater, altså reelle trombocytopenier. Det ble funnet trombocyttaggregater i blodutstryk i 36 av de 57 prøvene. Av de 36 positive prøvene, var 35 positive ved undersøkelse av buffycoat og 26 positive ved undersøkelse av fullblodsdråpe (tabell 1 og 2).
| FULLBLODSDRÅPE | ||||
| Negativ | Positiv | Total | ||
| Negativ | 21 | 0 | 21 | |
| BLODUTSTRYK | Positiv | 13 | 23 | 36 |
| Total | 34 | 23 | 57 |
Det ble påvist 22 negative prøver med buffycoat og 34 negative prøver ved bruk av fullblodsdråpe, som gir henholdsvis én og 13 falske negative prøver (tabell 1 og 2).
| BUFFYCOAT | ||||
| Negativ | Positiv | Total | ||
| Negativ | 21 | 0 | 21 | |
| BLODUTSTRYK | Positiv | 1 | 35 | 36 |
| Total | 22 | 35 | 57 |
Sensitivitet ved bruk av buffycoat og fullblodsdråpe, sammenlignet med standardmetoden blodutstryk, blir da henholdsvis 0,97 og 0,64 (tabell 3).
| Fullblodsdråpe | Buffycoat | |
| Sensitivitet | 0,639 | 0,972 |
Fullblodsdråpe var den raskeste metoden å utføre av de tre (cirka seks minutter). Buffycoat tok cirka 25 minutter og farging og vurdering av blodutstryk omtrent en time.
Shapiro-Wilk normalitetstest viste at differansene for parameterne leukocytter (WBC), trombocytter (PLT) og lymfocytter (LYMPH) før og etter uttak av buffycoat var normalfordelte. Paret t-test viste ingen signifikant forskjell mellom differansene ved 0,05 signifikansnivå (tabell 4).
| n | Gjennomsnitt før | SD (gjennomsnitt før) | Gjennomsnitt etter | SD (gjennomsnitt etter) | Differanse | SD (differanse) | p | |
| WBC | 56 | 6,62 | 5,30 | 6,60 | 5,28 | 0,02 | 0,30 | 0,646 |
| PLT | 55 | 49,73 | 22,70 | 49,29 | 22,44 | 0,44 | 4,52 | 0,477 |
| LYMPH | 55 | 1,13 | 0,79 | 1,11 | 0,78 | 0,02 | 0,08 | 0,095 |
Wilcoxon rangeringstest for de ikke-normalfordelte differansene for parameterne monocytter (EO), nøytrofile (NEUT), eosinofile (VAF) og basofile (BASO) granulocytter, viste heller ingen signifikant forskjell ved 0,05 signifikansnivå (tabell 5).
| Fortegn | n | Gjennomsnittlig rang | p |
| NEUT | |||
| Positiv | 23 | 26,41 | 0,458 |
| Negativ | 29 | 26,57 | |
| Null | 4 | ||
| MONO | |||
| Positiv | 22 | 25,25 | 0,571 |
| Negativ | 27 | 24,80 | |
| Null | 7 | ||
| EO | |||
| Positiv | 20 | 21,00 | 0,173 |
| Negativ | 16 | 15,38 | |
| Null | 21 | ||
| BASO | |||
| Positiv | 13 | 16,46 | 0,173 |
| Negativ | 12 | 9,25 | |
| Null | 32 |
Diskusjon
For de tre metodene som ble sammenlignet i denne studien var det enklest å påvise trombocyttaggregater i buffycoat. Sammenlignet med fullblodsdråpe har buffycoat høyere konsentrasjon av trombocytter, generelt større aggregater og fravær av erytrocytter. Denne metoden har heller ikke utfordringer knyttet til mulige fargeutfellinger, slik som ved blodutstryk.
Resultatene fra sammenlikningen mellom buffycoat og blodutstryk viser god overenstemmelse i antall positive og negative prøver for trombocyttaggregat. Kun én prøve viste falskt negativt resultat i buffycoat. Denne prøven hadde lavt prøvevolum og hemolyse, og det var derfor vanskelig å pipettere av buffycoat uten å få med erytrocytter. I blodutstryket fra samme prøve ble det funnet flere aggregater, som hver inneholdt > 10 trombocytter.
Fullblodsdråpepreparatet er vesentlig tykkere enn blodutstryk. Tilstedeværelse av erytrocytter gjør det derfor vanskeligere å påvise aggregater fordi erytrocyttene dekker over dem. Resultatene viste hele 13 falske negative funn ved undersøkelse i fullblodsdråpe sammenliknet med blodutstryk. Dette kan gi alvorlige konsekvenser knyttet til diagnose og behandling av pasienten.
Ved litteratursøk fant vi ingen kriterier for når en prøve skal regnes som positiv for trombocyttaggregat ved vurdering av fullblodsdråpe og buffycoatpreparat, og det var heller ikke fra vår side utarbeidet kriterier. Vi foreslo derfor først at definisjonen på en positiv prøve i buffycoat skulle være aggregater bestående av omtrent 20 trombocytter. Det viste seg imidlertid at det i praksis ikke er lett å telle antall trombocytter i et aggregat, og det ble bestemt at så lenge det var synlige aggregater til stede i preparatet ble prøven regnet som positiv. At det ikke ble funnet falske positive prøver ved undersøkelse av buffycoat taler for at dette er kriterier som kan benyttes. For fullblodspreparat ble det bestemt at trombocyttaggregatene måtte bestå av over fire trombocytter, og at det måtte være minimum fire aggregater; tilsvarende som for blodutstryk. Ved tvil om aggregater i fullblodsdråpe og buffycoat var store nok eller mange nok til å klassifisere prøven som positiv, ble preparatet mikroskopert av flere.
En potensiell feilkilde ved bruk av buffycoat er at store aggregater kan synke til bunnen av glasset og ikke være til stede i buffycoat. Det er antatt at aggregeringstendensen i en slik prøve vil fanges opp av instrumentet. Ved tilstedeværelse av flagget CLP, og ikke funn av trombocyttaggregater i buffycoat, vil det være aktuelt å lage blodutstryk i tillegg.
Preparatene (både buffycoat og fullblodsdråpe) må undersøkes innen fem minutter for å hindre uttørking. Ved uttørking av preparat vil plasma fordampe og føre til mindre avstand mellom cellene. Dette kan gi falsk aggregering. Blodutstrykene er ikke utsatt for dette problemet.
Det ble ikke påvist noen statistisk signifikant forskjell på hematologiske parameterne etter uttak av buffycoat. I tillegg er den prosentvise differansen mindre enn den analytiske CV %-verdien for alle parameterne. Dette betyr at differansen etter uttak av buffycoat ikke er av klinisk betydning, slik at prøvene kan benyttes til etterrekvirering.
Det er ikke funnet andre norske eller internasjonale studier som avkrefter eller styrker vårt funn. Videre studier kan være å undersøke hva andelen aggregerte trombocytter har å si for det totale antall trombocytter hos pasienten, med mål om å kunne angi grad av aggregering som vurderingskriterium og dermed si noe om det totale antall trombocytter.
Konklusjon
Påvisning av trombocyttaggregat ved bruk av buffycoat gir en sensitivitet på 97 % sammenlignet med blodutstryk. I tillegg er buffycoat tidsbesparende og en enklere metode enn blodutstryk for å påvise trombocyttaggregater. Det er ikke påvist noen statistisk signifikant forskjell i antall leukocytter og trombocytter etter uttak av 10 μL buffycoat. Den prosentvise differansen er mindre enn den analytiske variasjonen og har dermed ingen klinisk betydning. På bakgrunn av dette anbefales buffycoat som alternativ metode til blodutstryk for påvisning av trombocyttaggregater i diagnostiseringen av trombocytopeni og pseudotrombocytopeni.
Bruk av fullblodsdråpe anbefales ikke som et alternativ til blodutstryk.
Artikkelen er basert på en bacheloroppgave utført på Diakonhjemmet Sykehus av bioingeniørstudentene Hilde K. Omdal, Danijela Pavlovic og Rita Zora. Veiledere var seksjonsleder Msc. Siri Beisvåg Rom og avdelingssjef Msc. Gro Elisabeth Jensen. Intern veileder ved Høgskolen i Oslo og Akershus var Anne Karine Thorsrud.

