Innledning
Undersøkelse av leddvæske er helt sentralt for utredning og behandling av ulike typer revmatiske sykdommer. Differensialtelling av hvite blodceller i leddvæske vil kunne gi pasientene raskere diagnose og behandling (1). Det kan bli lettere å skille mellom en inflammatorisk og en ikke-inflammatorisk leddsykdom, samt å vurdere om det foreligger en infeksiøs artritt eller en krystallartritt.
Normal leddvæske er fargeløs, klar og har høy viskositet. Antall hvite blodceller er <0,2 *109 /L.
Ved ikke-inflammatoriske tilstander er antall hvite blodceller < 5,0 *109 /L, med < 50 prosent nøytrofile granulocytter. Inflammatorisk leddvæske er gul, uklar og vanntynn. Antall hvite blodceller er 10,0 -100,0 *109 /L, med 50 - 90 prosent nøytrofile granulocytter. En infeksiøs tilstand har vanligvis hvite blodceller >50,0 *109 /L og >95 prosent nøytrofile granulocytter (2). I følge revmatologer vil mononukleære celler være tilstede ved bakterielle artritter og enkelte hissige RA-artritter (3).
Referansemetode for differensialtelling av hvite blodceller i leddvæske er mikroskopi. Dette er en manuell metode som er svært tidkrevende. Metoden krever ekspertise på høyt nivå når det gjelder å identifisere celler, og det er en metode med svært dårlig reproduserbarhet selv blant erfarne bioingeniører (4).
Diakonhjemmet Sykehus har en stor revmatologisk avdeling med regionsansvar for revmatisk sykdom hos voksne. Avdelingen har pasienter med alle kategorier av revmatisme for utredning og behandling, Vi har mer enn 15 års erfaring med telling av totalt antall hvite blodceller i leddvæske ved hjelp av Coulter STKS, Cell-Dyn 4000 og nå Coulter LH750. Det vil være av diagnostisk betydning å skille mellom poly- og mononukleære celler. I utgangspunktet er hematologimaskinen laget for å kunne telle celler i blod. Tidligere har vi kun gitt ut totalt antall hvite blodceller i leddvæske.
Hensikten med denne studien var å sammenlikne manuell og automatisert metode for differensialtelling av hvite blodceller i leddvæske ved bruk av Coulter LH 750.
Materiale og metoder
Studien er utført i henhold til CLSI (The Clinical and Laboratory Standards Institute) sine retningslinjer for analysering av leddvæsker (5).
Det ble samlet 50 leddvæsker med gjennomsnittlig totalt antall hvite blodceller 15,6 *109 /L med standardavvik 22,1 *109 /L (0,4-119,1*109 /L) fra pasienter på revmatologisk poliklinikk. Leddvæske ble tappet fra hovne ledd i både kne, håndledd og ankel. Leddvæsken ble oppbevart på K2 EDTA-glass (PULS Norge) frem til analysering for å unngå at den koagulerte. Før automatisk differensialtelling ble alle leddvæsker behandlet med permease for å depolymerisere hyalonsyren som gjør leddvæsken seig. 10 μl (20 IE) permease (hyaluronidaseenzym fra CP Pharmacenticals Ltd Wrexham UK) ble tilsatt en milliliter leddvæske. Leddvæskene ble oppbevart i romtemperatur og tilsatt permease umiddelbart etter prøvetaking (5). Etter 15 minutters inkubering ble prøven analysert på Coulter LH 750 (Nerliens Meszansky AS) på samme måte som blodprøver.
Før manuell differensialtelling ble leddvæskene sentrifugert i minimum fem minutter for å konsentrere cellene. Celleknappen ble slemmet opp i to dråper plasma fra en tilfeldig giver for å gi cellene i leddvæsken et så gunstig miljø som mulig. Det ble laget utstryk i duplikat. Utstrykene ble fiksert og farget ved hjelp av May Grunwald-Giemsas fargemetode. (May Grunwald fargevæske fra Merck KGaA Germany, Giemsa fargevæske fra VWR International ltd England). I mikroskop ble det utført differensialtelling ved å telle 200 celler i hver leddvæske. Tre bioingeniører som alle er autoriserte på manuell differensialtelling, utførte den visuelle tellingen. Det ble utført en treparts differensialtelling (granulocytter, lymfocytter og monocytter). Det ble brukt to mikroskop: Leica DM 2500 (OneMed) og Zeiss (Zeiss, West Germany). Objektglassene var fra Menzel GmBH + Co KG. Tellingen ble utført blindt, det vil si uten å vite resultatet fra automatisk differensialtelling. Statistikkprogrammet Analyse It ble brukt til å bearbeide resultatene.
For instrumentet brukte vi samme kontrollmateriale som benyttes til differensialtelling av celler i blod. Tre nivå av CBC-kontroller (høy, medium og lav kontroll fra Bergmann Diagnostika) ble brukt som kontroll på totalt antall hvite og differensialtelling. Bakgrunnstelling blir utført hver morgen på maskinen. Akseptert bakgrunnsgrense på hvite blodceller er oppgitt fra produsent og skal være < 0,2 *109 /L.
Latron-kontroll (Beckmann Coulter) ble brukt som en spesifikk kontroll på VCS-målingen (volum, konduktivitet og scatter) i flowcellen.
Statistikk
Ved hjelp av statistikkprogrammet Analyse-It brukte vi Pearsons korrelasjonsplot for å finne korrelasjonskoeffisienten r. Deretter ble det gjort Passing & Bablok regresjonsanalyse for å sammenligne automatisk og manuell metode. Passing & Bablok regresjonsanalyse brukes rutinemessig ved vår avdeling ved metodeverifisering.
Resultater
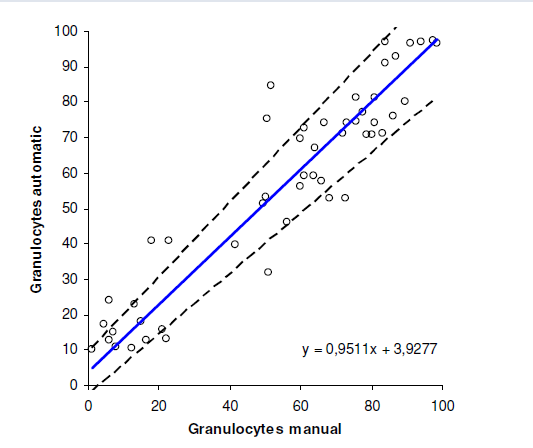
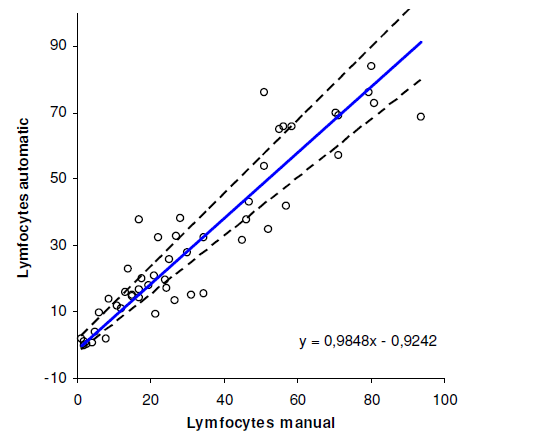
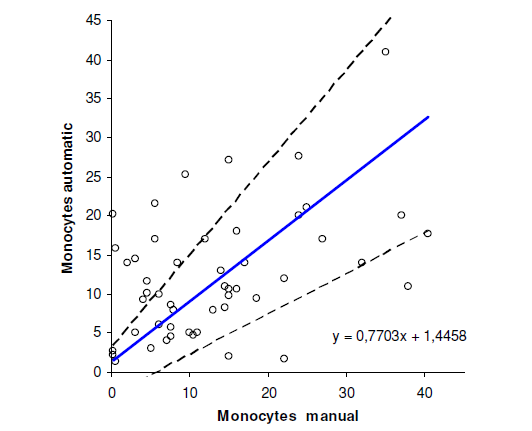
Sammenligning mellom manuell og automatisk metode er vist i figur 1,2 og 3. Regresjonsanalyse mellom de to metodene ble utført både på granulocytter, lymfocytter og monocytter og den lineære regresjonslinjen er vist i alle tre figurene. Pearsons korrelasjonsplot viste en korrelasjonskoeffisient r = 0,93, både på granulocytter og lymfocytter. Når det gjelder monocytter fikk vi en korrelasjonskoeffisient r = 0,44.
Diskusjon
Coulter LH750 får en høyere presisjon ved at den teller opptil 8000 celler. Visuelt telles bare 200 celler. Det er vanskelig å få høy presisjon ved manuell metode. Variasjonskoeffisienten mellom to bioingeniører er tidligere rapportert å være >20 prosent (7). Vi var tre bioingeniører som talte manuelt, og vi utførte kun parallelltellinger på de mest vanskelige leddvæskene.
Det er viktig at holdbarheten overholdes slik at permeasen skal kunne virke fullstendig på hyalonsyren og eventuelle sammenklumpinger av hvite blodceller. På grunn av leddvæskenes viskositet er det viktig å sentrifugere i minimum fem minutter (5).
Ut fra resultatene ser vi at det er en høy korrelasjon mellom automatisk og manuell differensialtelling, både når det gjelder lymfocytter og granulocytter. Det er ikke signifikant avvik mellom metodene. Det er foreløpig ikke et ønske fra klinikerne å få oppgitt antall mononukleære celler. Til tross for god korrelasjon mellom automatisk og manuell metode gis derfor ikke ut antall lymfocytter. Når det gjelder monocyttene er det signifikant avvik mellom metodene, og monocytter gis derfor ikke ut ved automatisk differensialtelling. Coulter LH750 teller gjennomsnittlig flere monocytter i hver leddvæske enn vi teller manuelt. Dette kan skyldes at ved manuell differensialtelling er det vanskelig å skille mellom lymfocytter og monocytter. Vi ser også dette ved vurdering av vanlig blodutstryk. I enkelte preparater blir cellene for sterkt farget og de ulike cellene kan derfor være vanskelige å identifisere. Under forbehandlingen kan det også bli tilsatt for lite plasma i forhold til celleantall, dette kan føre til dårlige preparat med ødelagte celler og artefakter.
Leddvæsker med lavt total antall hvite blodceller (<0,2 *109 /L) gir relativt dårlig overenstemmelse mellom de to metodene. Lavt antall hvite blodceller i leddvæske byr på utfordringer både for automatisk og manuell telling. Celletallet kan være lavere enn bakgrunnsgrensene i maskinen. Men det er viktig å nevne at dette er prøver der resultatet har liten klinisk betydning fordi resultatet er normalt. De fleste klinikere er interesserte i nøytrofile granulocytter når telletallet er > 0,2 * 109/L (3). Hvis totalt antall hvite blodceller < 0.2 * 109/L, registreres svaret som < 0.2 * 109/L og antall nøytrofile granulocytter som < 0.2 * 109/L. Tidligere studier har vist at det er unødvendig å utføre bakgrunnstest på Coulter LH 750 før hver enkelt leddvæske blir analysert (6). Det ble ikke brukt egne kontroller for leddvæske siden det er de samme reagensene og de samme kanalene som brukes ved analysering av blodprøver (5).
Feil prøvetaking kan også få konsekvenser for analyseringen. Hvis prøvetaker ikke treffer inne i selve leddkapselen kan man få tilblanding av andre celler fra synovialvevet, for eksempel makrofager og mastceller. Ved blodtilblanding kan man få falsk forhøyet antall hvite blodceller. Dette gjelder både manuell og automatisk analysering. Det er svært sjelden at vi får leddvæsker med synlig interferens. Skulle det være tilfelle har vi klare retningslinjer for når prøven kan analyseres og ikke. Synlig blodtilblandede prøver analyseres ikke. Vi er klar over at det kan forekomme interferens som ikke er synlig. Enkelte hematologimaskiner kan på grunn av interferens av synovial- og mesothelceller gi falskt økt leukocyttall (1). Vi kan ikke se denne interferensen på scatterplot fra Coulter LH 750. Dette har vi verifisert ved at automatisk og manuell metode viser god korrelasjon.
Konklusjon
Studien viser at det er god korrelasjon mellom manuell og automatisk differensialtelling av leddvæske for granulocytter og lymfocytter. Det er derimot ingen god korrelasjon for monocytter. Vi har med denne studien verifisert at vi kan utføre differensialtelling av hvite blodceller i leddvæske ved hjelp av Coulter LH 750. Vi gir heretter alltid ut antall nøytrofile granulocytter i tillegg til totalt antall hvite blodceller. Differansen vil være mononukleære celler (lymfocytter og monocytter).
Automatisk differensialtelling er raskere og analytisk mer presis enn manuell metode.
Dette gjør at man lettere kan skille mellom ulike tilstander, raskere stille en diagnose og derved gi pasienten bedre behandling.