Bakgrunn
Streptococcus pyogenes (β-hemolytiske streptokokker gruppe A; GAS) er en viktig årsak til bakterieinfeksjoner hos mennesker. GAS kan være årsak til flere ulike kliniske tilstander som for eksempel tonsillitt, brennkopper, sårinfeksjoner og mer alvorlige infeksjoner som sepsis og nekrotiserende fasciitt. I sjeldne tilfeller kan akutt glomerulonefritt eller reumatisk feber oppstå som senkomplikasjoner etter GAS-infeksjon (1). Streptococcus agalactiae (β-hemolytiske streptokokker gruppe B; GBS) er en mindre hyppig årsak til infeksjoner hos mennesker, men er likevel en viktig human patogen. GBS er den viktigste bakterielle årsak til alvorlige nyfødtinfeksjoner, som meningitt og sepsis. Hos voksne kan GBS gi urinveisinfeksjon, sårinfeksjon, sepsis og bløtvevsinfeksjoner (1).
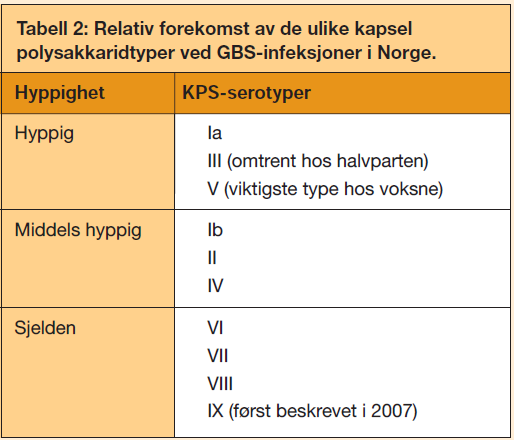
Serogruppebestemmelse, som er viktig for identifikasjon/artsbestemmelse av GAS og GBS, er basert på polysakkarider i bakterienes cellevegg. I epidemiologisk sammenheng har serotypebestemmelse vært viktig blant annet for å identifisere høyvirulente varianter av GAS og GBS. GAS kan serotypes i et mangfold av varianter basert på ulike protein (M-protein (emm-genet) og T-protein), som sitter på bakteriens overflate, samt serum opacity faktor protein (2). GBS kan types i 10 serotyper (Ia, Ib, II til IX) basert på kapsel polysakkarid (KPS), og videre serosubtypes på grunnlag av overflatelokaliserte og stammevariable proteiner. Proteinene inkluderer Cβ som kodes av bac, Cα (bca), og de alfa-lignenede proteinene Alp1(alp1), Alp2 (alp2), Alp3 (alp3), Alp4 (alp4), R4(Rib) (rib), samt R3-proteinet (et ikke-Alp) (3). Tabell 1 viser oversikt over de ulike kapseltype/proteinkombinasjoner GBS kan ha. Forekomst av de ulike kapseltypene ved GBS-infeksjoner i Norge er vist i tabell 2.
De fleste gener som koder for disse GBS proteinene har blitt sekvensert. Alle Alp har ensartet grunnstruktur med en N-terminus som er rettet utover fra bakterieoverflaten (ekstracellulær del), og en C-terminus som forankrer proteinet til bakterien (transmembran del). Den ekstracellulære delen inneholder et varierende antall repetisjoner som hver består av cirka 80 aminosyrer der viktige epitoper er lokalisert (3,4,5). Alp er chimerer slik at ulike protein kan ha nær identisk repetisjonsdel, men ulik N-terminus, eller identisk N-terminus men ulik repetisjonsdel blant annet med varierende og kompleks immunologisk kryssreaktivitet som resultat (3,4,5,6). Repetisjonene gjør at Alp danner stigelignende båndmønstre ved SDS-PAGE og Western blotting (3). Antistoffer mot Alp-epitoper beskytter mot GBS-infeksjon i dyremodeller (3). Serotyping og subtyping av GAS og GBS har tradisjonelt vært utført med immunologiske metoder som immunfluorescens, presipitasjon eller agglutinasjon (3), men har de senere år i økende grad blitt basert på PCR, såkalt ”molecular serotyping”.
Likheten mellom GAS og GBS på gennivå gjør at bakteriene kan syntetisere protein som er svært like. Et slikt protein er R28 som finnes hos en andel av GAS, og som ble vist å kryssreagere immunologisk med GBS-proteinet Alp3. Kryssreaktivitet er forståelig siden det viste seg at R28 og Alp3 har nær identisk sekvens og det er mulig at genet alp3 som koder for R28 og Alp3, har blitt overført fra GBS til GAS (8,9,10). Hensikten med vårt arbeid var å undersøke hvor ofte R28 opptrer hos GAS isolert fra pasienter i Norge, samt om en del andre viktige GBS-proteiner kan finnes hos kliniske GAS-stammer. Bortsett fra for R28, er vi ukjent med at dette har vært systematisk undersøkt hos GAS.
Materiale og metoder
Bakterier
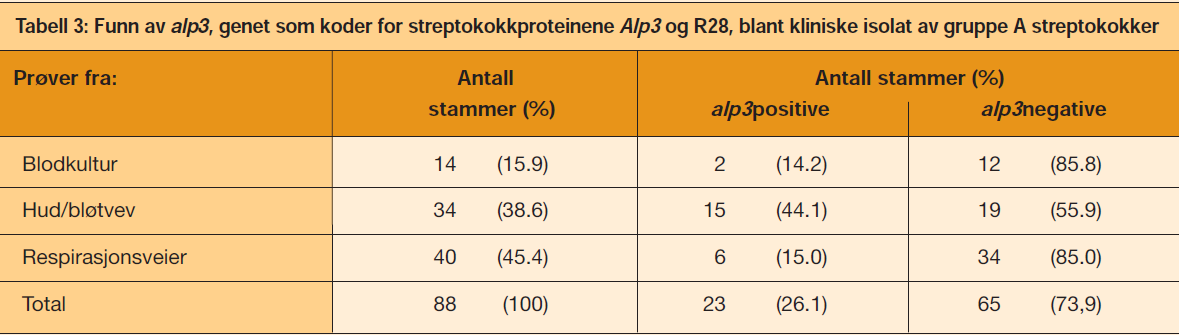
Totalt ble 88 kliniske GAS-stammer testet, derav 14 stammer isolert fra blodkulturer, 34 fra hud- og bløtvevsinfeksjoner og 40 stammer fra respirasjonsveiene, hovedsakelig fra halsprøver. Stammene var isolert fra prøver innsendt fra sykehus og legesenter i Midt-Norge i perioden 2004 til 2006. Stammene ble tilfeldig valgt. Lancefieldgrupping ble utført med Pastorex ™Strep kit 61721(Bio-Rad Laboratories, Frankrike), som er et agglutinasjonssystem basert på latexpartikler merket med antistoff mot gruppespesifikke karbohydrat i bakteriens cellevegg. I mange tilfeller manglet opplysninger for en nøyaktig klinisk kategorisering, bortsett fra hvor prøvematerialet var hentet fra. GBS-referanse- og prototypstammer, og GAS-stammen R28, ble hentet fra samlingen av referanse- og prototypisolater ved Avdeling for medisinsk mikrobiologi, St. Olavs hospital i Trondheim. Stammesamlingen inkluderer alle kjente GBS-kapselvarianter og stammer som uttrykker ett eller flere overflatelokaliserte protein; Cβ, Cα, Alp1(epsilon), Alp2, Alp3, Alp4, R4(Rib) og R3. Referanse- og prototypstammer for samtlige av markørene ble benyttet i innledende forsøk for å få bekreftet at PCR og antisera som ble benyttet i studien hadde den spesifisitet som var forutsatt. Bakteriene var oppbevart i -80 oC i Greaves medium
(glycerol/albumin/glutaminsyre; prod. Avd. for medisinsk mikrobiologi, St. Olavs hospital), og ble dyrket 20 timer på blodagar.
Oligonukleotid primere
Primere for bruk i multiplex PCR for deteksjon av protein antigen gener var konstruert
(Eurogentech S.A., Seraing, Belgia) som beskrevet av Creti et al. (11) og inkluderer primere for genene bca, rib, alp1(epsilon), alp2/3 og alp4, som koder for proteinene Cα, R4(Rib), Alp1, Alp2 eller Alp3, og Alp 4. Forward primer er felles for alle genene mens reverse primere er genspesifikke (11). Primerpar GBS1360S-GBS1937A (amplicon 652 bp) ble benyttet for bac-genet som koder for Cβ proteinet (12) og parene bal23S1-bal2A2(426 bp) og bal23S1-bal3A (321 bp) for å skille mellom alp2 og alp3 (12).
Påvisning av genet for protein R3 lar seg ikke gjennomføre, da genet ikke er sekvensert.
PCR
Bakteriene ble lysert med proteinase K som tidligere beskrevet (13). Multiplex PCR ble utført som beskrevet (11) med unntak av at antall sykluser ble økt fra 30 til 35 for å øke mengden av PCR-produktet. For påvisning av bac genet og hvert av genene alp2 og alp3, ble PCR utført etter følgende betingelser: Reaksjonsmiksen (50 μl) inneholdt: 2 μl template; 1 x PCR buffer; 0,75mM MgCl2; 50 μM av de ulike dNTP (dATP, dCTP, dGTP, dTTP), 0,4 μM konsentrasjon av hver av primerne; 1,5 U AmpliTaqGold® polymerase N8080241 (Applied Biosystems, Roche). Perkin Elmer GeneAmp PCR System 2400 ble benyttet, og med 35 sykluser (denaturering 94 oC i 1 minutt; annealing 55 oC i 1,5 minutter; ekstensjon 72 oC i 2 minutter) med avslutning 72 oC i 7 minutter. PCR-produktene ble analysert ved bruk av DNA 1000 LabChip kit på Agilent 2100 Bioanalyzer (Agilent Technologies) anvendt som beskrevet fra fabrikanten.
Antisera
To ulike antisera fra kanin ble benyttet, ett tilrettelagt for reaksjon med begge GBS-proteinene Alp3 og R4(Rib) (anti-Alp3/R4 common), og ett som reagerer med GBS-proteinet R3. Immunisering, kryssabsorpsjon og spesifisitetstesting er beskrevet tidligere (5,14). Anti-Alp3/R4 common bindes også til GAS-proteinet R28 sannsynligvis fordi R28, Alp3 og R4(Rib) har nær identiske bindingsseter i proteinenes repetisjonsdel. Monoklonalt og polyklonalt antistoff mot GBS-proteinet R3 har tidligere vært beskrevet (14). Alle antistoff har vært testet mot referanse- og prototype GBS-isolater for å bekrefte ønsket spesifisitet.
Western blotting
I alt ble 22 GAS testet med anti R3-serum, og 18 GAS og 4 GBS med anti Alp3/R4 common serum. Lysat av hele celler av GAS og GBS ble fremstilt som beskrevet (13). Oppsummert ble bakterier dyrket i 15 ml Todd-Hewitt buljong (BactoTMTodd Hewitt Broth Cat.no249240, Frankrike) i 37 oC i 20 timer, sentrifugert, vasket to ganger med fosfatbufret saltvann (PBS), resuspendert i 100 μl sample buffer, og varmet (100 oC) i 5 minutter. Uoppløselig materiale ble fjernet med sentrifugering og 20 μl ble deponert per brønn for SDS-PAGE på NuPAGE Novex Bis-Tris Gels NPO301 BOX (Invitrogen life technologies, Carlsbad, USA). Bufferløsninger var som beskrevet for elektroforeseseparasjon. For øvrig ble prosedyren utført som beskrevet (15). Kanin antisera for probing ble brukt i fortynning 1:1000, peroxidasekonjugert anti-kanin IgG og substrat for synliggjøring av antistoffbinding var som beskrevet (15). Reaksjonen ble stoppet ved å legge stripsene i vann.
Statistikk
Chi-square test ble benyttet for å evaluere forskjeller mellom bakteriegruppene, med P<0.05 vurdert som statistisk signifikant.
Resultater
PCR ble først evaluert ved å undersøke GBS-stammer av kjente serotyper og serosubtyper fra laboratoriets samling med laboratoriestammer. PCR som var konstruert for gener som koder for GBS-proteinene Cß, Cα, Alp1(Epsilon), Alp2, Alp3, Alp 4 og R4(Rib), ga resultater i overensstemmelse med tidligere antistoffbasert typing av stammene i henhold til informasjon fra referanselaboratoriene American type culture collection (ATCC; Atlanta) og National collection of type cultures (NCTC; London). Figur 1 viser eksempler på alp3 PCR-resultater med alp3 PCR-positive og negative stammer.
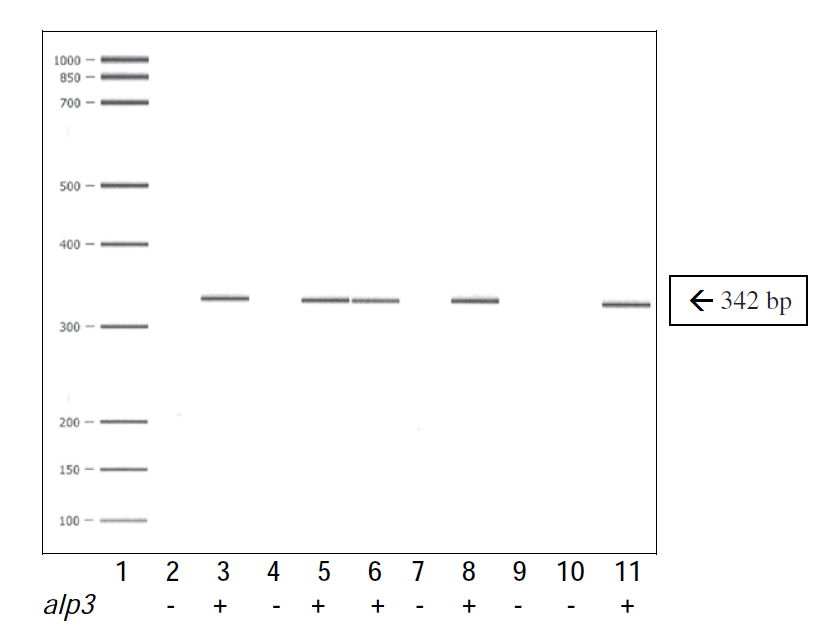
Størrelsen på PCR-produktene er som beregnet teoretisk (11). Antiserum mot R3-proteinet viste positivt resultat i Western blotting kun med våre R3-referansestammer, 10/84 (V/R3; ATCCC 49447) og 9828 (NT/Alp4, R3; NCTC 9828). Resultatene sannsynliggjør at både PCR og den antistoffbaserte R3-proteintesten sikret pålitelig resultat.
88 kliniske GAS-stammer fra respirasjonsveier, blodkultur eller fra hud og bløtdelsprøver ble undersøkt med tanke på alle de åtte overflatemarkørene som undersøkelsen var rettet mot. Syntese av R3-proteinet ble ikke funnet blant 22 GAS-stammer som ble undersøkt med R3-antiserum. PCR konstruert for genene som koder for Cß, Cα, Alp1 (Epsilon), Alp2, Alp4 og R4(Rib) var negativ for alle 88 GAS-stammer som ble testet, noe som sannsynliggjør at ingen av disse genene finnes hos GAS.
Genet alp3 som koder for proteinet Alp3, en benevnelse brukt i relasjon til GBS, eller koder for R28, en benevnelse brukt i relasjon til GAS, ble funnet hos 23/88 (26 %) av GAS-stammene (Tabell 3), men med hyppighet som varierte med stammenes kliniske utgangspunkt. Prevalens av GAS-stammer fra blodkultur som hadde alp3 (14,3 %) var som for stammer fra respirasjonsveiene (15 %), mens GAS fra hud og bløtdelsinfeksjoner hadde langt høyere forekomst av alp3 (44 %), som vist i Tabell 3.
Prevalensen for alp3 var statistisk signifikant høyere med GAS fra hud enn med GAS fra respirasjonsveiene (p = 0,006) og betydelig høyere enn for GAS fra blodkultur (p = 0,049).
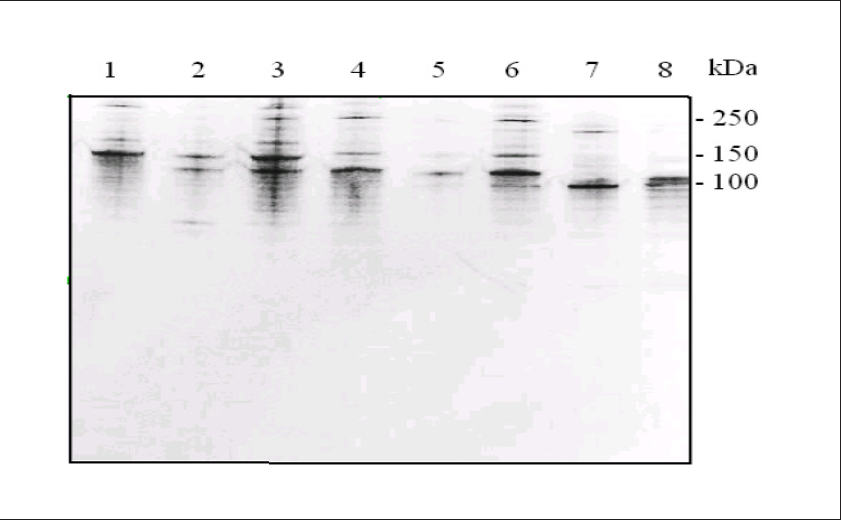
Totalt ble 18 av GAS-stammene, 15 alp3 positive og 3 alp3 negative, testet i Western blotting mot anti-Alp3/R4(Rib) common antistoffer som reagerer med de nær identiske repetisjonsdelene på Alp3, R4(Rib) og R28, men ikke bindes til andre alfalignende proteiner (5,8,9,10). Alle 15 alp3 PCR-positive stammer viste båndmønster som indikerte at disse stammene syntetiserte antistoffbindende antigen som vi oppfattet var R28. Figur 2 viser resultatene av Western blotting med sju tilfeldig valgte alp3 PCR-positive GAS-stammer, alle med båndmønster som indikerer protein med høy molekylær masse, stort sett høyere enn 100 kDa, multiple bånd og stamme- til stammevariasjon som er velkjent for alfa-lignende proteiner (3). Laboratoriets GBS prototypestammer som ble testet til å være PCR negative for alp3, viste ingen tegn til antistoffbinding eller uspesifikk immunoglobulinbinding (ikke vist). Resultatene viste overensstemmelse mellom funn av alp3 og av genproduktet R28.
Diskusjon
Vi skulle i denne studien undersøke hvor ofte R28 opptrer hos GAS isolert fra pasienter i Norge, samt om en del andre viktige GBS-proteiner kan finnes hos kliniske GAS-stammer.
Nærmere 50 % av genomet hos GAS og GBS er nær identiske (3,7), noe som indikerer lik struktur av mange GAS- og GBS-proteiner. Det har lenge vært kjent at immunologisk kryssreaktivitet som indikerer likhet i struktur, eksisterer mellom overflatelokaliserte GAS- og GBS-protein (16). Nylig ble det vist at dette spesielt gjelder GAS-proteinet R28 og at genet som koder for dette er identisk med GBS-genet alp3, som koder for GBS-proteinet Alp3 (8,10 ). Repetisjonsdelen av R28 (og Alp3) er også identisk med repetisjonsdelen av GBS-proteinet R4(Rib) som imidlertid har N-terminus noe forskjellig fra R28/Alp3 sin N-terminus (8,9). Den immunologiske kryssreaktiviteten som følger av dette er viktig, fordi den gir beskyttende kryssimmunitet (10). Eksempelvis er det en mulighet at rekombinant fremstillet repetisjonsdel av proteinene kan inngå i en fremtidig vaksine for å oppnå økt motstand mot infeksjoner med mange stammevarianter av GAS og GBS.
Det har blitt foreslått som en mulighet at GAS-genet som koder for R28-proteinet, kan ha blitt overført fra GBS til GAS (10). Andre GBS-gener kan tenkes å ha blitt overført til GAS. Vi undersøkte derfor i denne studien forekomst i GAS-stammer av GBS-gener som koder for velkjente GBS overflateproteiner og undersøkte med Western blot om GBS-proteinet R3 ble uttrykt i GAS. Blant 88 undersøkte GAS-stammer var det bare alp3-genet som koder for R28 i GAS og Alp3 i GBS, som ble funnet. Dette tyder på at den omfattende sekvenslikheten som er påvist mellom GAS- og GBS-genomene (7) gjelder gener som koder for andre proteinkategorier enn stammevariable overflateproteiner, f. eks. enzymer som er viktige i bakterienes metabolisme. Alp3 synes å innta en særstilling blant overflatelokaliserte GBS-proteiner, noe som kan ha sammenheng med at genet hos GAS er lokalisert til et større genetisk element (RD2) som har karakter av mobilt element, der alp3 finnes sammen med gener som koder for flere andre proteiner (17). Alp3-positive stammer må antas å være bærere av RD2-elementet. Vi er ikke kjent med funn som indikerer at alp3 er knyttet til et lignende element hos GBS.
I 1975 ble det vist at R28-proteinet er identisk med eller er en viktig del av T28-antigenet hos GAS (18). GAS med T28-egenskapen finnes som oftest sammen med M28 (emm28)-egenskapen som, i likhet med flere andre M-proteinvarianter, er en viktig virulensfaktor for GAS (18,19). Av GAS stammene vi undersøkte hadde 26 % genet alp3 som alene eller sammen med andre gener koder for T28-egenskapen. T28-egenskapen ble funnet hos 31 % av invasive GAS-stammer fra Sverige (20) og hos 34 % av GAS-stammer isolert fra blodkultur i Finland (21), noe som stemmer bra med våre funn. T28 positiv GAS har spesielt vært assosiert med barselfeber (22,23). Vi fant at nærmere halvparten av GAS fra hud og bløtdelsinfeksjoner var alp3-positive, langt hyppigere enn stammer fra blodkultur eller luftveier. Dette tyder på at alp3-produktet R28 er en virulensfaktor ved GAS-infeksjoner i huden, for eksempel ved å fungere som adhesin som kan bidra til å forankre bakteriene til en reseptor i huden. R28 er vist å fungere som adhesin til epitelceller, en egenskap som ble blokkert med R28-spesifikt antistoff (10). Imidlertid, siden mer enn 50 % av hudisolatene var alp3 negative, kan sannsynligvis også andre overflatelokaliserte GAS-komponenter formidle binding av bakteriene til hudceller og/eller andre strukturer i huden.
Konklusjon
Resultatene våre har vist at det er høy forekomst av genet alp3 og R28-ekspresjon blant GAS-stammer fra pasienter i Midt-Norge, og at forekomsten er klart høyest for isolater fra hud og/eller underliggende bløtdeler med infeksjon. For forskere vil det være en utfordring å studere mekanismene ved adhesjon av GAS til hud, inkludert den rolle R28 spiller.