Last ned pdf:
Alternativ til rescreening av livmorhalsprøver.pdf
Livmorhalskreft er den fjerde vanligste kreftformen blant kvinner i verden (1). I Norge har det vært en nedgang på 25 % i forekomst og 50 % i dødelighet av sykdommen etter innføring av en nasjonal masseundersøkelse mot livmorhalskreft i 1995, heretter kalt Livmorhalsprogrammet (2). I Livmorhalsprogrammet oppfordres kvinner mellom 25 og 69 år til å ta en celleprøve fra livmorhalsen hvert tredje år, for å oppdage eventuelle celleforandringer eller kreft (3). Livmorhalskreft skyldes i 99 % av tilfellene en vedvarende infeksjon av humant papillomavirus (HPV) av høyrisikotype (4). I løpet av en livstid vil 70-80 % av alle kvinner bli smittet av HPV, men mindre enn 10 % av disse vil få en vedvarende infeksjon og en større risiko for å utvikle kreft. I over 90 % av tilfellene klarer immunforsvaret å bekjempe en HPV-infeksjon (3, 5).
I dag sendes celleprøvene fra livmorhalsen til cytologisk undersøkelse, for å se om det foreligger forandringer som graderes etter Bethesdaklassifikasjonen (se faktaboks) (6). Et representativt preparat må inneholde minst 5 000 celler, og kan inneholde over 100 000 celler (6, 7). Eventuelle unormale celler er ofte i fåtall, og det er derfor viktig at preparatet blir systematisk gjennomgått. Ved færre enn 25 unormale celler kan det være vanskelig å finne celleforandringer (7).
HPV smitter i hovedsak seksuelt, ofte via rifter eller sår i livmorhalsslimhinnen eller i overgangssonen mellom plateepitel og sylinderepitel (8). HPV som infiserer hud og slimhinner i anogenitalregionen utgjør den største gruppen av HPV-genotyper. Disse kan grupperes i lav- og høyrisikotyper ut fra om de er forbundet med kreftutvikling eller ikke (tabell 1) (4, 8).
| Gruppe | HPV-genotyper |
| Høyrisiko | 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 |
| Sannsynlig høyrisiko | 26, 53, 66, 68, 73, 82 |
| Lavrisiko | 6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81, CP6108 |
E6 og E7 er to virusgener som undertrykkes ved forbigående virusinfeksjoner. Ved vedvarende HPV-infeksjoner, også kalt transformerte, kommer reguleringen av E6 og E7 ut av kontroll. Dette fører til at undertrykkelsen av E6 og E7 stopper opp, og dermed øker de i produksjon og aktivitet (5).
Økt uttrykk av E6 fører til binding og degradering av tumorsupressorgenet p53. p53 mister da sin funksjon og cellene kan dele seg med DNA-skade. Dette gir ukontrollert cellevekst som igjen kan føre til kreft (9, 10).
E7 binder og degraderer tumorsupressorgenet retinoblastoma protein (Rb). Rb binder normalt den spesifikke transkripsjonsfaktoren E2F, slik at denne blir inaktiv. Frigjøring av E2F fører til produksjon av proteiner som bidrar til celledeling og overproduksjon av p16INK4a (p16). Dette gir ukontrollert og kontinuerlig cellevekst, og kan resultere i kreftutvikling (9-11).
CINtec® PLUS er en immuncytokjemisk analyse for kvalitativ påvisning av proteinene p16 og Ki-67 i samme celle, i et cytologisk preparat fra livmorhalsen. p16 finnes i kjerne og cytoplasma. Ki-67 er forbundet med celleproliferasjon og uttrykkes i kjernen til prolifererende celler. Påvisning av begge proteinene i samme celle er et tegn på deregulert cellesyklus og mulige forstadier til kreft (12).
Hensikten med studien var å finne ut om dobbel immunfarging av p16 og Ki-67 i cellepreparat fra livmorhalsen kan benyttes til å lokalisere forstadier til livmorhalskreft hos kvinner med normal celleprøve og positiv HPV-DNA-test.
Materiale og metode
Restmateriale fra 25 livmorhalsprøver (væskebasert cytologi) ble benyttet i studien. Prøvene var vurdert ved Seksjon for cytologi, Avdeling for patologi og medisinsk genetikk, St. Olavs Hospital i 2013. Utvalgskriteriene var kvinner som hadde fått sin celleprøve vurdert som cytologisk normal og testet positiv for HPV-DNA med analysen Hybrid Capture® 2 High-Risk HPV DNA Test™ (Digene Corporation, USA). Testen påviser høyrisiko-genotypene av HPV og sannsynlig høyrisiko-genotype 68. Seks til tolv måneder tidligere hadde kvinnene som var inkludert i studien, blitt diagnostisert med cytologisk diagnose ASC-US eller LSIL. I studien ble det benyttet en positiv og en negativ kontroll i form av et cytologisk preparat med diagnose HSIL som var HPV-DNA-positivt, og et normalt som var HPV-DNA-negativt.
De cytologiske preparatene av restmateriale fra original prøvebeholder ble preparert med ThinPrep® 2000 (Hologic®, USA). Preparat for både immuncytokjemisk farging og Papanicolaous fargemetode (PAP-farging) ble laget av prøver og kontroller. Preparatene til immuncytokjemisk farging ble oppbevart ved – 20 °C i ett døgn, før de ble rehydrert og farget med CINtec® PLUS Kit (Roche mtm laboratories AG) for dobbel immunfarging av p16 og Ki-67. Farging av p16 er basert på omdannelse av kromogenet 3,3’-diaminobenzidine (DAB), til et brunt produkt. Ki-67 påvises med alkalisk fosfatase-mediert omdannelse av kromogenet Fast Red til et rødt produkt. Resultatet er positivt dersom en eller flere celler har både tydelig brunt cytoplasma for påvist p16 og rød kjerne for påvist Ki-67. Resultatet er negativt dersom kun ett eller ingen av proteinene er påvist i samme celle, eller ved svak farging. Den immuncytokjemiske undersøkelsen ble håndtert og farget i henhold til forhandlers prosedyre (13). Det andre settet med preparater ble farget med standard PAP-metode.
Prøver hvor det ble påvist dobbel immunfarging, ble sammenlignet med den korresponderende prøven farget med PAP-metode. Det ble vurdert om tilsvarende celler kunne finnes igjen i dette preparatet og om de eventuelt hadde celleforandringer med diagnose ASC-US, LSIL, ASC-H eller HSIL. De originale cytologiske preparatene ble vurdert på nytt i de tilfellene hvor det ble lokalisert celleforandringer ved hjelp av CINtec® PLUS. Alle preparatene ble mikroskopert med BX50 (Olympus Corporation, Japan) ved 100x og 400x forstørrelse.
Resultater
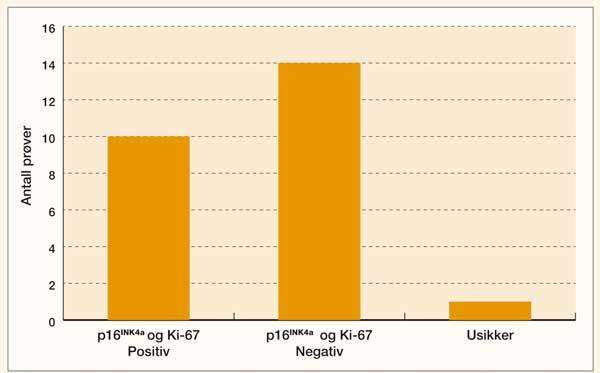
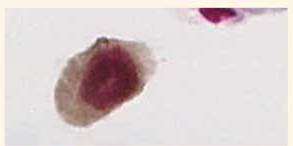
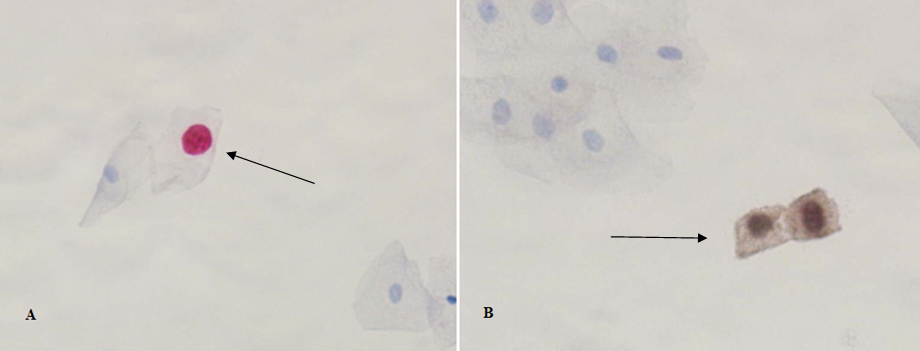
10 av 25 prøver var positive ved dobbel immunfarging for både p16 og Ki-67, mens én prøve var usikker (figur 1). Den positive kontrollen inneholdt celler med økt uttrykk av både p16 og Ki-67, som ble vist i form av dobbel immunfargede celler (figur 2). Den negative kontrollen inneholdt ikke dobbelfargede celler. Både kontrollene og prøvene inneholdt celler med enkelfarging av enten p16 eller Ki-67 (figur 3).
De ti prøvene som var positive ved dobbel immunfarging av både p16 og Ki-67, ble også vurdert med PAP-metode. Av disse ti prøvene ble det funnet tre med diagnosen ASC-US og én med diagnosen LSIL (figur 4). De samme diagnosene ble gjenfunnet i de originale preparatene ved revurdering, representert ved to til fem unormale celler.
Diskusjon
I denne studien ble det undersøkt om dobbel immunfarging av p16 og Ki-67 kan benyttes til å lokalisere celler som kan representere forstadier til livmorhalskreft hos kvinner med normal celleprøve og positiv HPV-DNA-test.
Uttrykk av ett av proteinene (p16 eller Ki-67) i en celle er naturlig: Ki-67 sees i prolifererende celler og p16 regulerer cellesyklus. Samtidig uttrykk av begge proteinene i samme celle forekommer vanligvis ikke i normale celler og er et tegn på deregulert cellesykluskontroll.
Fire av de ti celleprøvene som var positive ved dobbel immunfarging, viste diagnosene ASC-US og LSIL ved vurdering av både det nye preparatet og det originale preparatet farget med PAP-metode. De resterende positive celleprøvene ble vurdert til å være normale i preparatene farget med PAP-metode. Dette kan ha sammenheng med at CINtec® PLUS kan fange opp økt uttrykk av virusgenene E6 og E7 før celleforandringer kan sees.
Ved farging med CINtec® PLUS kunne positive celler skilles fra negative, der cellene lå enkeltvis og var tydelig positive med brunt cytoplasma og rød kjerne. Ved grupper av celler som overlapper hverandre kan det være vanskelig å avgjøre hvilke cytoplasma og kjerner som hører sammen (figur 4A). Dette er noe man må være klar over ved dobbelfarging. Skillet mellom lysebrunt og lyseblått cytoplasma kan være utydelig når fargene er tett opptil hverandre. Det samme gjelder mørkebrune og mørkerøde kjerner.
Cytologisk diagnostikk er en subjektiv vurdering der cellemorfologi vurderes ut fra kriterier gitt av Bethesdaklassifikasjonen. Primærscreening er svært konsentrasjonskrevende, og i tilfeller med få cytologisk unormale celler i et preparat er risikoen større for at de kan bli oversett. Ved å bruke dobbel immunfarging kan denne feilkilden bli mindre. Ved gjennomgang av preparatet ved 100x forstørrelse kan mulige forstadier til livmorhalskreft lettere lokaliseres enn ved standardisert PAP-farging. Siden preparatene kun er kontrastfarget med Hematoxylin vil de brune p16 og røde Ki-67-positive cellene komme godt frem, mot de normale cellene som er blå. Mulig dobbelfarging må verifiseres ved 400x forstørrelse. CINtec® PLUS positiv farging viser N/C-ratio, men gir ikke en tydelig kromatinstruktur i kjernen fordi detaljene dekkes over med immunfarging. De morfologiske kriteriene må bekreftes i et preparat farget med PAP-metode. Cytologisk revurdering av utvalgte prøver utføres i dag ved cytologiske laboratorier som en kvalitetskontroll, og kan være et like godt alternativ som dobbel immunfarging. ASC-H er en diagnose som fører til at kvinnen må til kolposkopi og biopsi, som ved histologisk oppfølging har en treffsikkerhet på cirka 50 % for behandlingstrengende forstadier (2). Det betyr at cirka 50 % av disse kvinnene har benigne tilstander eller lavgradige forstadier. Henvisning til kolposkopi og biopsi ved ASC-H kunne kanskje vært unngått ved å benytte dobbel immunfarging, men det må vurderes i mer omfattende studier.
I fremtiden vil HPV-testing sannsynligvis bli primærscreeningsmetode, da dette er 20-25 % mer sensitivt enn cytologisk vurdering for å påvise høygradige celleforandringer (14). CINtec® PLUS kan benyttes for å undersøke om virusgenene E6 og E7 er under kontroll eller ikke. CINtec® PLUS er i dag en relativt kostbar analyse, men dersom nytteverdien viser seg stor vil sannsynligvis flere aktører komme på markedet med kit for dobbel immunfarging, og kostnaden vil følgelig bli redusert. HPV-testing i screening mot livmorhalskreft har tidligere blitt mer omfattende beskrevet i Bioingeniøren i artikkelen ”HPV, celleforandringer og kreft” (15).
Våre resultater viser at dobbel immunfarging kan benyttes til å finne celler med celleforandringer i prøver som er vurdert som cytologisk normale og er testet HPV-DNA-positive. For å få et mer pålitelig og statistisk signifikant resultat burde flere prøver vært undersøkt og sammenlignet med en kontrollgruppe. Funnene i studien resulterte i nye rutiner for kvalitetskontroll ved cytologilaboratoriet ved St. Olavs Hospital. Prøver som er primærscreenet og vurdert som cytologisk normale og samtidig testet HPV-DNA-positive, blir nå revurdert. Siden resultatet fra HPV-testen da er kjent, vil den som revurderer prøven bruke mer tid på å finne unormale celler. Immuncytokjemisk farging med CINtec® PLUS ble ikke innført, da revurdering av preparater kan være en like god metode for kvalitetskontroll som dobbel immunfarging.
Artikkelen bygger på en studie som ble gjort som bacheloroppgave i 2013 ved Bioingeniørutdanningen, Avdeling for teknologi, Høgskolen i Sør-Trøndelag, Trondheim.