Dette er en norsk utgave av en originalartikkel som ble publisert i Transfusion and Apheresis Science i 2009. Artikkelen er oversatt av Anne Røsvik.
Referanse, PubMed: Rosvik AS, Ulvik RJ, Wentzel-Larsen T, Hervig T. The effect of blood donation frequency on iron status. Transfus Apher Sci 2009;41: 165-9.
Introduksjon
Økt behov for blodkomponenter gir økt press på arbeidet med å rekruttere og beholde blodgivere. I Norge er antall mulige givere økt med én prosent på seks år (1999-2005) mens antall transfunderte enheter av erytrocytter er økt med ni prosent i samme periode (1). Tidligere studier har vist at det er vanskelig å rekruttere nok nye givere og at givere som gir ofte får lavere jernstatus (2-5). Jernstatus er definert som konsentrasjon av Hb og ferritin. Ved en fullblodsgivning mister man fire - ti prosent av kroppens jern. Dette fører til et fall i Hb-konsentrasjonen i tre dager etter tappingen (6). Flere studier har bekreftet at blodgivning henger sammen med nedsatt ferritin (3, 7-9). Kort tid mellom tappinger kan øke risikoen for jernmangel, mens lengre intervall samt jerntilskudd etter donasjonen, kan hindre jernmangel (6).
Den økende andelen av kvinnelige blodgivere tilsier at det er viktig å kontrollere jernstatus, siden det fysiologiske jerntapet er større hos menstruerende kvinner enn hos menn (10).
Ved å måle sTfR (løselig transferrinreseptor) kan en skille mellom jernmangelerytropoiese og tomme jernlagre, mens ferritinmåling bare gir informasjon om jernlageret. En sammenligning av ferritin og sTfR hos frekvente blodgivere viste at mens 63 prosent av kvinnene hadde ferritin under grenseverdien for tomme jernlager, var det bare 17 prosent som hadde patologisk økt sTfR (11). Dette tydet på jernmangelerytropoiese. Hos menn var de tilsvarende andelene henholdsvis seks prosent og åtte prosent. I følge en annen studie av de samme forfatterne, kan jernmangel hos anemiske pasienter best oppdages ved å bruke TfR-F-indeks, som er forholdstallet mellom sTfR og log ferritin (12). Derfor vil måling av Hb og ferritin alene ikke være nok til å oppdage overgang fra tomme jernlagre til jernmangelerytropoiese (13).
Hovedmålet med denne studien var å først beskrive endringer i jernstatus i løpet av ett år med givninger hos nyrekrutterte givere som ikke fikk jerntilskudd etter givning. Vi ville også utvikle en modell for mulige samspill mellom frekvens av donasjoner og Hb, ferritin og TfR-F-indeks for å kunne forutsi de negative effektene av blodgivning på jernstatus.
Materiale og metode
Design
Vi observerte nye givere over ett år i en longitudinal studie. Giverne var rekruttert mellom juni 2005 og juni 2006. Disse giverne fikk ikke jerntilskudd etter donasjon, og Hb og ferritin ble målt ved hver donasjon i denne perioden. Effekten av fire donasjoner på jernstatus ble så studert ved å modellere longitudinelle data fra hver deltaker.
Deltakere
En gruppe på 1026 godkjente nye blodgivere (651 kvinner og 375 menn) ved Haukeland Universitetssjukehus i Bergen, ble spurt om å delta. De var godkjente etter EUs blodgiverdirektiv (14), der Hb er den eneste laboratorietesten for jernstatus. 893 ville delta (87 prosent av de spurte). 563 (63 prosent) var kvinner og 330 (37 prosent) var menn.
Av de som deltok hadde 87 prosent ferritinkonsentrasjon ≥ 18 µg/L ved inkluderingstidspunktet. Minimumsintervallet mellom donasjoner var tre måneder. Underveis i studien ville 32 kvinner (seks prosent) og sju menn (to prosent) trekke seg eller de ble rådet til å trekke seg på grunn av fallende ferritinkonsentrasjoner ned mot grenseverdien for tomme jernlagre. Disse deltakerne fortsatte som vanlige givere i en egen ”jerntilskuddsgruppe”. Målingene for disse giverne etter dette tidspunktet ble ikke tatt med i studien. I tillegg ble 35 kvinner og 17 menn ekskludert på grunn av at vi manglet startdata om sTfR for dem. Vi hadde fullstendige data om fire givninger fra 133 kvinner og 117 menn. Data fra alle deltakerne ble imidlertid inkludert i modellen (en ”mixed effect” modell som beskrevet i statistikkavsnittet), enten de hadde mange eller få målinger, noe som ga modellen stabilitet.
Gjennomsnittsalder var 29 år (SD = 10) for kvinner og 31 år (SD = 10) for menn. Alderen lå mellom 18 og 63 år for begge kjønn. Alle deltakerne var motiverte til å gi blod jevnlig, med minst tre måneder mellom hver gang.
Etikk
Studien var godkjent av den regionale komiteen for medisinsk og helsefaglig forskning i Vest-Norge (REK Vest), og ble utført i henhold til Helsinki-deklarasjonen. Alle blodprøver var samlet etter instruksjoner gitt i informasjonsbrevet, der deltakerne ga informert samtykke til å delta. Deltaking var frivillig.
Laboratorietester
Alle blodprøver ble trukket fra satellittposene foran den donerte enheten i tappeposene. Hb ble analysert på Advia 120 (Bayer Diagnostics, Tarrytown, USA), med variasjonskoeffisient (CV) på 0,8 prosent. Ferritin ble målt på Modular PP, Tina Quant (F.Hoffman - La Roche Ltd., Basel, Sveits), med CV < 4 prosent. Etter 29. januar 2007 ble ferritin målt på Modular E (ECLIA, electrochemiluminescence immunoassay, Roche Diagnostics GmbH, D-68298 Mannheim), med CV < 4 prosent. For å unngå skjevhet på grunn av endring i målemetode, brukte vi parede data fra 145 tidligere blodprøver som var analysert med begge metodene (det gamle Modular PP og det nye Modular E). Vi logtransformerte ferritin målt på begge metodene og brukte lineær regresjon til å utlede følgende formel for overgangen fra ferritin målt ved Modular PP til Modular E: ferritin fra Modular E = exp[-0,004 + 1,069 • ln(ferritin fra Modular PP)], der exp er eksponentialfunksjonen.
sTfR ble analysert ved Dade Behring, N latex sTfR-metoden (Behring Nephelometer II, Dade Behring Marburg GmbH, Tyskland) med referanseintervall: 0,84 -1,54 mg/L fram til og med 29. januar 2007, med CV 4 prosent. Etter denne dato ble sTfr analysert ved Tina Quant Soluble Transferrin Reseptor-metoden (ACN 665, Roche Diagnostica, Modular P, Japan), med CV 3,5 - 4,5 prosent, og nytt referanseintervall: kvinner 1,9 - 4,4 mg/L og menn 2,2 - 5,0 mg/L. For å unngå skjevhet på grunn av metodeendring ble sTfR-verdier fra 29. januar 2007 eller tidligere, multiplisert med en faktor på 1,5 (på grunnlag av beregninger ved testlaboratoriet). For å kunne ekskludere betennelser, lever- og nyresykdommer, ble C-reaktivt protein (CRP), alanin aminotransferase (ALAT), aspartat aminotransferase (ASAT), alkalisk fosfatase (ALP), γ-glutamyltransferase (γ-GT) og kreatinin målt ved Modular PP, Tina Quant.
Statistiske analyser
Ferritinmålinger ble logtransformert og oppgitt som geometrisk gjennomsnitt. Tidsforløpet for Hb og logtransformert ferritin fra første til siste givning ble modellert ved hjelp av lineære blandet effektmodeller. Vi justerte for startverdier og også for alder og TfR-F-indeks ved oppstart. Antall donasjoner og tid siden forrige donasjon inngikk i modellen som forklaringsvariable som varierte innen målingene fra hver giver. Samspill mellom antall donasjoner med tid siden forrige donasjon og med TfR-F-indeksen ble tatt med i modellen. Modellene ble estimert separat for hvert kjønn. SPSS 15 (SPSS Inc., Chicago IL, USA) og R ble brukt til dataanalysene (15), med R-pakken “nlme” (for nonlinear and linear mixed effects modell) for blandet effektmodell (16).
Resultat
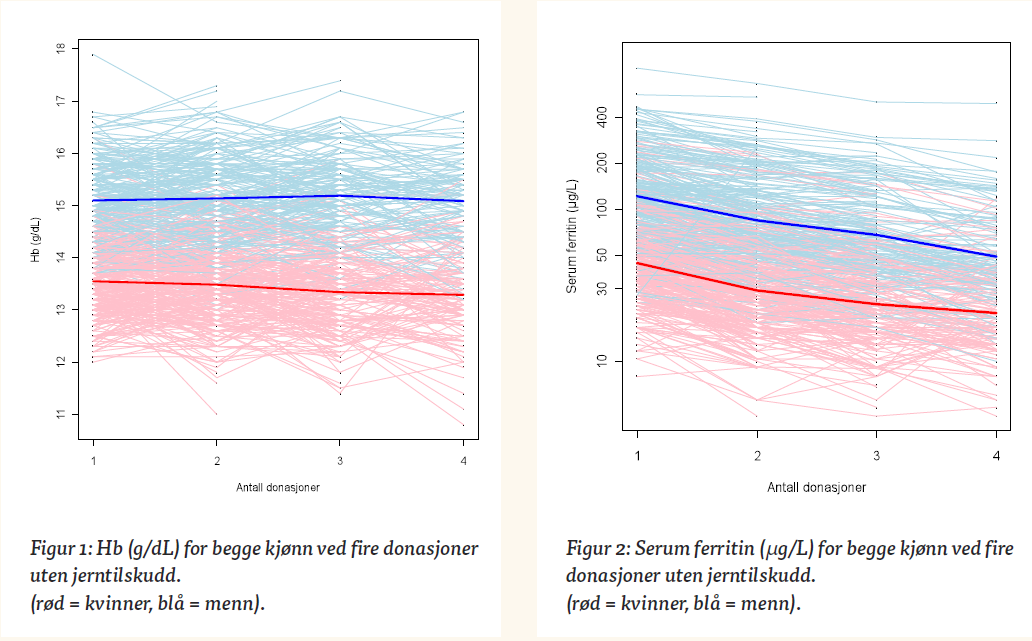
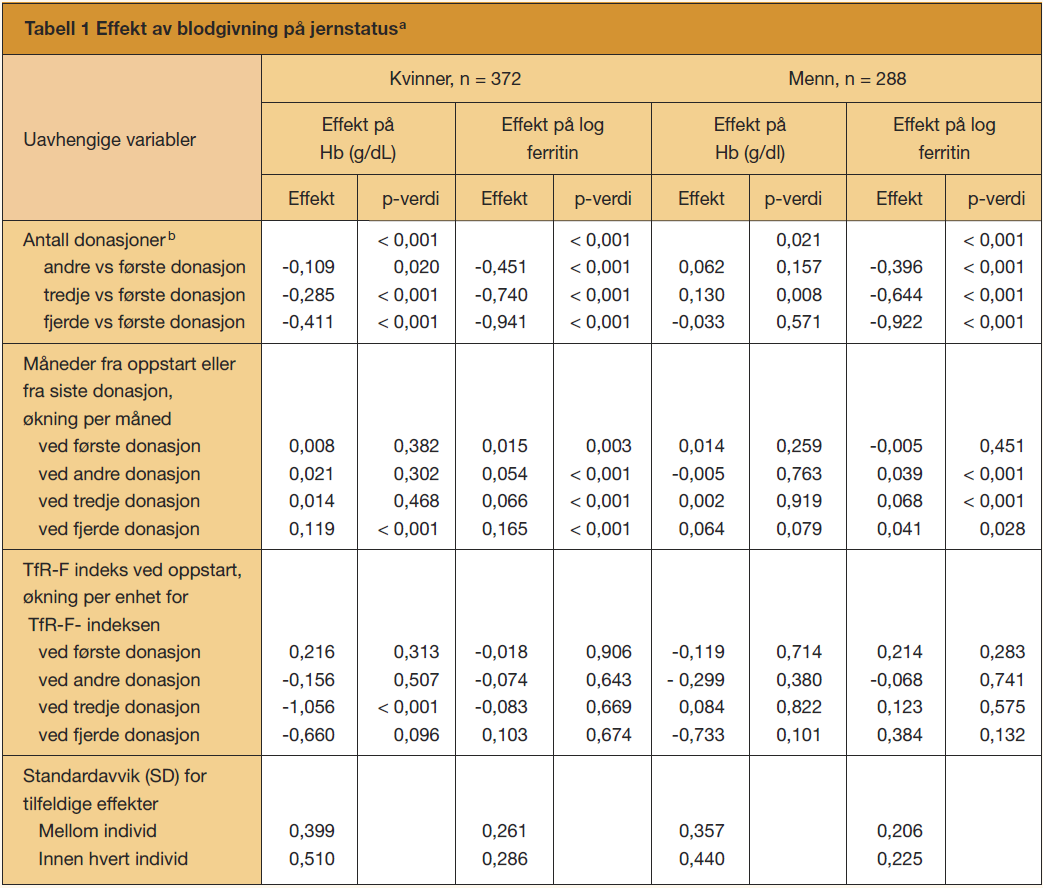
Endringene i Hb og ferritin for de første fire donasjoner er vist i figur 1 og 2.
Andelen deltakere som var igjen (i prosent av totalt tilgjengelige givere) ved hver donasjon var ved første givning 60 prosent (392 givere), ved andre givning 47 prosent (308), ved tredje givning 35 prosent (228) og ved fjerde givning 20 prosent (133) for kvinner. For menn var de tilsvarende tall 79 prosent (297), 67 prosent (253), 50 prosent (188) og 31 prosent (117).
For kvinner var det signifikant samspill mellom antall givninger og tid siden siste givning for Hb (P = 0,027) og ferritin (P < 0,001). Det var en positiv sammenheng mellom alder ved oppstart og ferritin (P < 0,001), men ikke Hb (P = 0,056). For menn var det signifikant samspill mellom antall givninger og tid siden siste givning for ferritin (P < 0,001), men ikke for Hb (P = 0,350), mens alder ved oppstart ikke hadde noen effekt på jernstatus (P 0,140).
Hb og ferritin sank med antall givninger for kvinner og ferritin sank med antall givninger for menn. Denne nedgangen i Hb og ferritin var svakere hvis det gikk lang tid mellom givninger, spesielt mellom tredje og fjerde donasjon. For menn var det ingen klar sammenheng mellom Hb og antall donasjoner (Tabell 1).
For Hb hos kvinner var det signifikant samspill mellom antall donasjoner og TfR-F-indeksen (P < 0,001). Spesielt ved tredje donasjon var Hb lavere for de høyere verdiene av TfR-F-indeksen. Dette så vi ikke for ferritin hos kvinner, eller hos menn. Det var stor tilfeldig variasjon for Hb og ferritin både mellom individer og ved gjentatte målinger for de samme individene, se SD for de tilfeldige effektene i tabell 1.
Diskusjon
Forholdet mellom jernstatus og behov for jerntilskudd ved gjentatte blodgivninger er stadig kontroversielt. Selv om det er problematisk å tilrå bruk av jerntilskudd for friske personer, vil slikt tilskudd kunne øke antall donasjoner (3, 7, 17). Når presset på de etablerte blodgiverne øker for å kunne opprettholde et tilstrekkelig blodlager, blir det nødvendig å sette opp en blodgivningsprotokoll som gjør at givere unngår jernmangel med anemi og svekket helse på grunn av dette.
I EU sitt bloddirektiv er Hb-konsentrasjon innenfor satte grenser det eneste kravet til jernstatusen for en giver (14). Vår modell viser at for kvinnelige givere kan lengre tid mellom givningene forebygge nedgang i Hb, mens kortere intervall kan benyttes for enkelte av de mannlige giverne. Kvantitative estimat for disse sammenhengene er vist i tabell 1. Ferritin brukes i enkelte blodbanker som tilleggsmarkør for jernstatus. Hvis ferritin viser seg å være under det mest brukte cut-off-nivå på 15µg/L, indikerer dette tomme jernlagre og giveren blir avvist eller gitt jerntilskudd. Alternativt kan tidsintervall mellom donasjoner økes. Modellen vi presenterer i tabell 1 understreker behovet for tilpassede donasjonsintervall basert på data om Hb og ferritin. Dette er spesielt viktig hvis jerntilskudd ikke blir vurdert.
Våre funn støttes av andres, men noen forskere bruker celleindekser (red cell indices) eller TfR–F-indeksen til å forutsi og evaluere jernmangel hos blodgivere (11, 18). Milman et al (19) fant at hos kvinner hadde hyppighet av donasjoner større betydning for jernlageret enn antall donasjoner, og dette stemmer med våre funn. Men i motsetning til deres funn om at ferritin falt fra første til andre givning og så ble stabilisert, fant vi et kontinuerlig fall i ferritinkonsentrasjon. At jernmangel forekommer hyppigere hos menstruerende kvinner enn hos kvinner etter menopause (19, 20) understreker muligheten til å justere tappeintervall for giveren basert på jernstatus. Økning i sTfR er en sensitiv indikator for jernmangelerytropoiese, mens fall i ferritin er en markør for jernmangel og svake jernlagre (11). Når disse indikatorene kombineres iTfR-F-indeksen, øker den diagnostiske sensitiviteten for jernmangel, med eller uten samtidig anemi (12, 21). I følge Boulton et al (22) kan ikke TfR-F-indeksen forutsi hvem som vil utvikle jernmangel etter donasjon, mens vår studie fant at høyere TfR-F-indeks gjør kvinner mer sårbare for negative effekter av blodgivninger.
Måling av ferritin kan avdekke jernoverskudd grunnet genetiske disposisjoner for hemokromatose (23). Hvis hemokromatose er til stede vil det være feil å tilby jerntilskudd. Personer med hemokromatose som ellers kan inkluderes som blodgivere, kan trygt gi fire ganger per år eller av og til enda oftere, avhengig av jernstatusen.
Vår modell for effekten av tid mellom donasjoner hos givere som ikke får jerntilskudd, bruker variablenes startverdier til å forutsi resultat fra påfølgende målinger av Hb og ferritin. Siden modellen bare inneholder fire påfølgende donasjoner, er dette ikke vitenskapelig grunnlag for å si noe om de eventuelle påfølgende donasjonene. Likevel viser modellen effekter av forklaringsvariabler (antall donasjoner, tid mellom donasjoner og startverdier for alder, Hb, ferritin og sTfR) på avhengige variabler (Hb og ferritin ved hver donasjon). Derfor peker modellen på de forholdene som er viktige for ”overvåking” av blodgivere. Slik informasjon kan gjøre at vi klarer å beholde blodgivere lenge.
Konklusjon
Hos friske norske blodgivere ga gjentatte donasjoner uten jerntilskudd signifikant reduksjon i Hb for kvinner og i ferritin for både kvinner og menn. På grunnlag av startverdier for Hb og ferritin kan vår modell brukes til å bestemme blodgivningsintervall for å unngå anemier og/eller jernmangel hos givere som ikke får jern. Økt TfR-F-indeks ved oppstart forutsa lave påfølgende Hb-målinger hos kvinner, mens denne testen ikke ga noe tilleggsinformasjon for menn.
Takk
Vi takker Helse Vest for støtte til denne forskningen. Vi takker også Jerard Seghatchian ved Blood Components/Apheresis Technology & Thrombosis / Haemostasis Consultancy, London, England, for rådgiving til manuskriptet. Vi takker alle ved Laboratorium for klinisk biokjemi (LKB), Haukeland Universitetssjukehus, Bergen, for laboratorietestingen og for å skaffe data om endringer i biokjemiske metoder, og vi takker Jorunn Vadheim ved blodbanken på samme sykehus for hennes arbeid med datasamlingen.