Bakgrunn
Ved graviditet og før en mulig transfusjon, skal det tas blodprøver som undersøkes for irregulære blodtypeantistoffer (antistoffscreening). Antistoffscreeningen skal i følge «Veileder for transfusjonstjenesten i Norge» (1) gjøres med indirekte antiglobulinteknikk (IAT) (1). IAT kan brukes på flere måter; i gelkort, kolonner, mikrotiterplater eller glass (2 - 6). Cellene til IAT i glass har tradisjonelt vært fortynnet til 3 % cellesuspensjon med PBS og hatt holdbarhet i ett døgn (3). Blodbanken i Oslo (BiO) bruker IAT i glass til få prøver og må kaste relativt mye av cellesuspensjonene på grunn av den korte holdbarheten. Av denne grunn ønsket vi å gå over til en fortynningsløsning som gir cellene lengre holdbarhet og bestemte oss for å teste ut Ec-Stabilizing solution fra BioRad. Ec-Stabilizing solution gir celler i 3-5 % suspensjon holdbarhet i to uker (7). Vi er ikke kjent med at andre blodbanker i Norge lager celler i 3-5 % suspensjon med Ec-Stabilizing solution til IAT i glass. Produsenten bruker denne eller tilsvarende løsning til cellene de selger til IAT i glass, men vi har ikke klart å finne artikler om utprøving av denne løsningen.
I følge bruksanvisningen (pakningsvedlegget) (7) til Ec-Stabilizing solution skal cellene oppbevares ved +2 til +8 oC, mens de skal ha romtemperatur ved bruk. BiO tar i mot hasteprøver hele døgnet og må alltid ha cellene klare til bruk. Vi ønsket derfor å sammenlikne reaksjonsstyrken til celler oppbevart i romtemperatur og kjøleskap.
Hensikten med denne studien var å undersøke om celler fortynnet med Ec-Stabilizing solution ga forventede positive og negative reaksjoner ut fra fenotypen til cellene, uavhengig av spesifisiteten og styrken til antistoffet. Et viktig poeng i denne undersøkelsen var å finne ut om det var forskjell i resultatene for de svakeste antistoffene. Vi ønsket også å teste ut om testcellene løst i Ec-Stabilizing solution var holdbare i to uker.
Materiale og metoder
Studiedesign
Vi laget en firedelt hypotese om at det er ingen forskjell om:
1) cellene er fortynnet med PBS eller Ec-Stabilizing solution og oppbevart i romtemperatur
2) cellene er fortynnet med PBS eller Ec-Stabilizing solution og oppbevart i kjøleskap
3) cellene fortynnet med Ec-Stabilizing solution er oppbevart i romtemperatur eller kjøleskap
4)cellene fortynnet med Ec-Stabilizing solution er oppbevart én dag eller to uker.
Prøvemateriale
Vi benyttet plasma/serum prøver fra eksterne kvalitetskontroller (fra Norge, Sverige, England og Belgia) og noen pasientprøver. Identiteten til pasientene ble fjernet før prøvene ble analysert. Siden prøvene ble anonymisert og brukt til metodesammenlikning, var det ikke nødvendig å søke Regional etisk komite (REK) om tillatelse.
Totalt ble 37 prøver analysert. Prøvene inneholdt minst ett antistoff innenfor alle de fem vanligste og klinisk viktige blodtypesystemene (Rh, MNSs, Duffy, Kidd og Kell) (1).
For å få prøver med svake antistoffer, ble 26 av prøvene fortynnet. Fortynningene ble gjort med en fortynningsvæske bestående av like deler PBS og blodtypenøytralt serum (AB-serum). Prøvene ble frosset (- 20 °C) før første og mellom hver analysering.
Celler
Prøvene ble analysert mot BiOs tre screeningceller og tre utvalgte celler fra BiOs eget cellepanel, slik at alle aktuelle antigen var representert med minst en negativ, en homozygot og en heterozygot celle. Alle cellene var frosset og tint etter metoden i Högmans artikkel (8). Dagen før hver første analysedag ble celler til fortynning med Ec-Stabilizing solution tint og det ble laget to sett; ett sett ble oppbevart i kjøleskap, og det andre settet ble oppbevart i romtemperatur. Cellene fortynnet med PBS var de samme som ble brukt i rutinen.
Analysering
Prøvene ble analysert med nylagede celler fortynnet i Ec-Stabilizing solution; første analysedag (= Dag 1), etter at de var oppbevart én uke (= Dag 7) og etter at de var oppbevart to uker (= Dag 14). Grunnen til at vi analyserte dem også etter én uke, var at vi ønsket et alternativ dersom cellene ikke gav tilfredsstillende resultat etter to uker. Ved alle tre analysedagene ble prøvene også satt opp mot celler fortynnet i PBS.
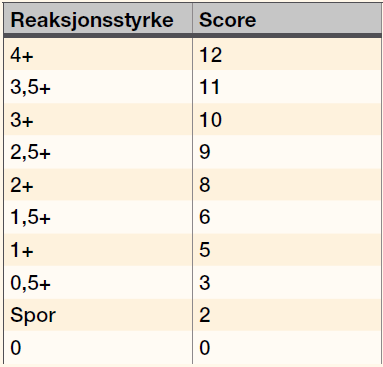
IAT i glass er en manuell analyse der bioingeniøren som utfører analysen graderer agglutinasjonsreaksjonen makroskopisk fra negativ til 4+. Graderingene for hver prøve ble gjort om til score etter en anerkjent omgjøringstabell (Tabell 1) (6).
Deretter summerte vi scoren for de 6 cellene hver prøve ble satt opp mot. Vi fikk da tre scoresummer for hver prøve, en for hver «variant» av cellesuspensjoner (celler fortynnet i PBS, celler fortynnet med Ec-Stabilizing solution og som er oppbevart i romtemperatur og celler fortynnet med Ec-Stabilizing solution og som er oppbevart i kjøleskap), hver analysedag. Forskjell i score for hver prøve mellom de tre cellevariantene, ble analysert statistisk (se Tabell 2, 3 og 4).
Vi valgte å analysere differansene i score for alle prøvene, for prøvene analysert Dag 1 og Dag 14 (Dag 1 og Dag 14 er mest interessant med tanke på om vi kan ta løsningen i bruk, se over). Alle prøvene ble analysert statistisk fordi vi da fikk mange prøver, og vi antok at «slengere» dermed ville ha mindre betydning.
Statistikk
Statistisk analysering ble gjort med statistikkprogrammet Analyse-IT ® (statistisk analyseprogram for Microsoft Excel, Analyse-it Software, Ltd.). For å sammenlikne resultater mellom de ulike fortynningsløsingene og oppbevaringstemperaturene (avhengig data) ble Wilcoxons test for ikke-parametriske data og Passing & Bablok test benyttet.
Wilcoxons test for pardata ble brukt for å få oversikt over antall positive, negative og like differanser. Wilcoxons test (9,10) er en ikke-parametrisk test som kan brukes for å analysere differanse mellom to datasett. Testen kan brukes når differansene ikke er normalfordelte, men skal brukes med forsiktighet når mange av prøvene som sammenlignes har like differanser. Det er en regresjonsmodell der y= a+bx og b=1. Er metodene like, vil det ikke bli forskjell i scoren og differansene blir null.
Passing & Bablok test er også en ikke-parametrisk regresjonsanalyse (y= a+bx), men her testes det på feil/avvik både i konstantleddet (a) og i stigningskoeffisienten (b). Passing & Bablok test (10, 11) tillater målefeil i en eller begge metodene. Målefeilene må ikke være normalfordelte. Når metodene gir samme resultat blir a=0 og b=1. Denne testen gir ikke ett tall som sier om metodene er signifikant forskjellige eller ikke, men man bruker konfidensintervallet (KI) til henholdsvis konstanten og stigningskoeffisienten for å undersøke om det er sannsynlig at metodene er like eller ikke på det nivået man tester på. Passing & Bablok test (10, 11) ble brukt for å sammenligne de ulike cellesuspensjonene i denne studien og ble brukt på 5 % nivå. Det betyr at når 95 % av konfidensintervallet (KI) for konstanten (a) omfatter tallet 0, er det 95 % sannsynlig at det ikke er en signifikant forskjell mellom metodene, uavhengig av konsentrasjonen. Tilsvarende gjelder for stigningskoeffisienten (b); hvis 95 % KI for stigningskoeffisienten omfatter tallet 1, er det ikke signifikant forskjell på metodene.
Resultat
Prøvene
Det ble analysert 37 prøver og 11 antistoffer med ulike titer, fordelt på blodtypesystemene Rh, MNSs, Duffy, Kidd og Kell . 26 prøver var fortynnet for å gi svake reaksjoner. Av tekniske årsaker ble ikke alle prøver analysert alle dager; Dag 1 (n=35), Dag 7 (n=20) og Dag 14 (n=36). Alle prøvene ble analysert parallelt med celler i PBS (n=91). Prøvene ble analysert blindet slik at de som utførte analysene ikke viste hvilke antistoffer som var forventet. I to av prøvene fra Dag 1 var det tekniske problemer med cellene fortynnet i PBS. Disse prøvene ble utelatt i sammenligningen med celler i PBS, men kunne tas med i sammenligningen av celler fortynnet med Ec-Stabilizing solution med ulik oppbevaringstemperatur.
Det var ingen falskt positive reaksjoner, men fire falskt negative reaksjoner. Alle resultatene er tatt med i de statistiske beregningene. Alle graderingene ble gjort om til score (etter tabell 1) (6) for den enkelte prøve, for å kunne regne på resultatene statistisk. Til sammen ble 93 scoresummer for de ulike fortynningsløsningene/oppbevaringstemperaturene analysert statistisk.
Statistisk analyse
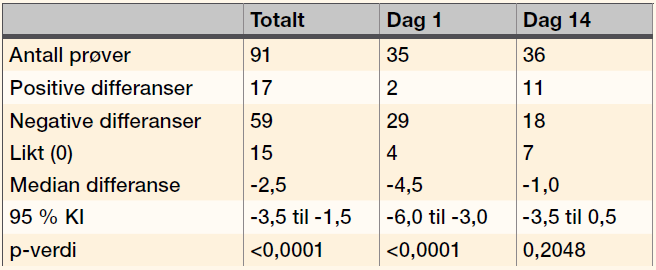
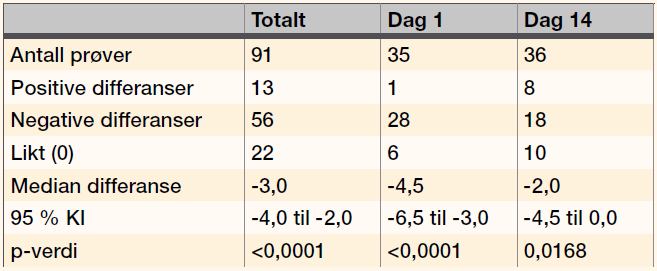
Gjennomsnittsscore for alle prøvene var 22,3 (0-53) for celler fortynnet i PBS, og 24,8 (0-58) og 25,6 (0-60) for celler fortynnet i Ec-Stabilizing solution oppbevart i henholdsvis romtemperatur og kjøleskap. Medianene var 21,1, 23,0 og 24. Wilcoxons test for pardata (forskjell i score) ble brukt til å sammenligne scoren for celler i PBS mot i Ec-Stabilizing solution. Mange av differansene ble negative. Det var færre negative differanser når celler i Ec-Stabilizing solution oppbevart i romtemperatur eller kjøleskap ble sammenlignet. Resultatene var tilsvarende når vi analyserte resultatene fra Dag 1 eller Dag 14 separat (Tabell 2, 3 og 4).
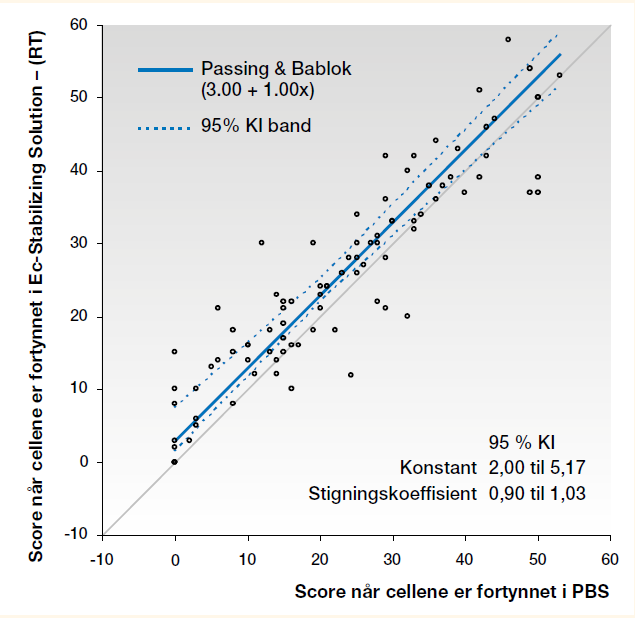
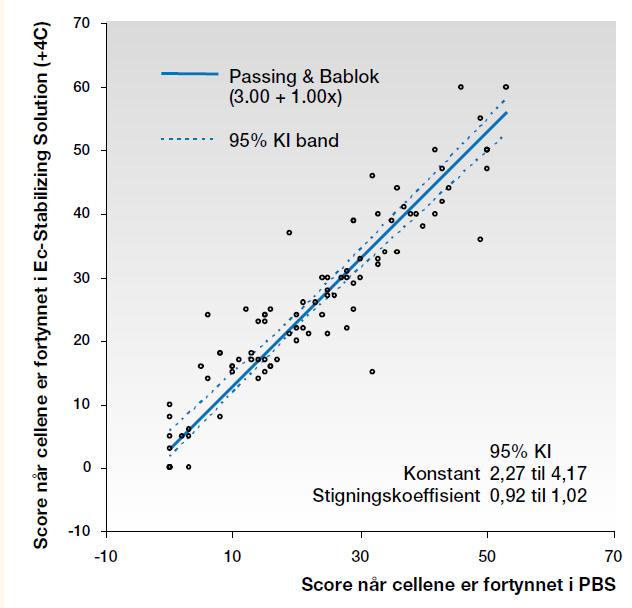
Passing & Bablok test. Sammenligning av scoren for celler i PBS med celler i Ec-Stabilizing solution, viste at 95 % av konfidensintervallet (KI) til konstanten ikke inneholdt 0 (null) (Figur 1 og 2).
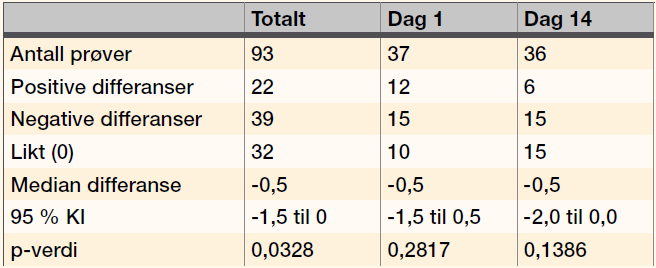
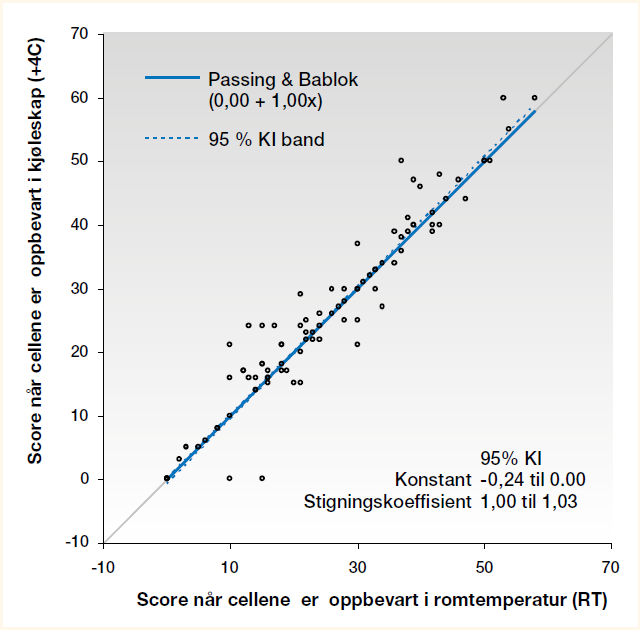
Når vi sammenlignet scoren for celler fortynnet med Ec-Stabilizing solution oppbevart i romtemperatur og kjøleskap, omfattet 95 % av KI for konstanten 0 (null) (Figur 3).
Avvikene var ikke påvirket av scoren da 95 % av KI til stigningskoeffisienten omfattet 1 (en) i alle sammenligningene.
Diskusjon
Prøvematerialet og celler
Ved metodesammenligning anbefales det å analysere 20 – 40 prøver på alle aktuelle nivåer/konsentrasjoner (11). Vi analyserte prøver med ulike titer i, men valgte flest prøver med svake antistoffer, siden disse er teknisk vanskeligst å påvise og var av den grunn viktigst å få undersøkt. Antall prøver med lavt antistofftiter ble derfor størst.
Prøver med 11 ulike antistoffspesifisiteter (anti-D, anti-E, anti-c, anti-C(w), anti-D og anti-C, anti-K, anti-S, anti-N, anti-Fy(a), anti-Jk(a) og anti-Jk(b)). Antall prøver for hvert antistoff som ble testet, ble styrt av tilgang på prøvemateriale (en – seks prøver per antistoff). Vi klarte ikke å skaffe fem prøver med antistoff innen Kidd-systemet, men valgte likevel å analysere materialet.
Resultatene for celler i Ec-Stabilizing solution ble sammenlignet med samme dags oppsett av celler i PBS, for å sikre at analyseteknisk variasjon, samt frysing og tining av prøvene, skulle ha minst mulig påvirkning på sammenligningene.
For å sørge for at at alle de fem vanligste og klinisk viktige antigenene var representert som homozygote, heterozygote og negative (1) var det tilstrekkelig å teste med seks celler og ikke hele cellepanelet. Det var nødvendig å analyser mot så få celler som mulig fordi IAT-glass bruker fire dråper plasma til hver celle og tilgangen på prøvemateriale er begrenset.
Celler som skulle gi negative reaksjoner ble tatt med for å påvise eventuelle falsk positive reaksjoner. Da blodtypeantistoff kan vise doseeffekt (2, 5), måtte vi ha med både hetero- eller homozygote celler for de ulike antigenene.
Utførelse og avlesning
IAT i glass er en manuell metode der agglutinasjon avleses makroskopisk og graderes. Graderingen kan variere noe fra person til person, særlig for de svakeste reaksjonene.
Betydningen av variasjon i graderingen ble redusert ved å sette opp prøvene mot celler i PBS hver analysedag. Denne mulige variasjonen påvirket derfor i liten grad resultatet av sammenligningene.
Celler fortynnet med PBS sammenliknet med fortynning med Ec-Stabilizing solution
Gjennomsnittsscoren ble lavere ved analysering med celler fortynnet med PBS enn når cellene var fortynnet med Ec-Stabilizing solution, uavhengig av om vi ser på alle prøvene eller de enkelte analysedagene.
Det kan se ut til å være en systematisk forskjell på scoren når cellene er fortynnet med PBS sammenliknet med når de er fortynnet med Ec-Stabilizing solution, enten de er oppbevart i romtemperatur eller i kjøleskap. Forskjellen er tilsvarende om cellene er nylaget eller er oppbevart i to uker.
Passing & Bablok test viste at 95 % av KI til konstanten ikke omfattet 0 ved sammenligning av alle prøvene og prøvene analysert Dag 1. For prøvene analysert Dag 14 omfattet 95 % av KI konstanten 0. Det er statistisk signifikant forskjell på metodene ved sammenligning av alle resultatene og resultatene for Dag 1, men ikke for resultatene for Dag 14. Mulig årsak til denne forskjellen kan være at det er relativt få prøver, noe som gjør at resultatene kan bli påvirket av såkalt «slengere», men selvsagt kan vi ikke utelukke at alderen til cellene også kan ha betydning. Ingen signifikant forskjell viser at cellene fortynnet med Ec-Stabilizing solution er holdbare og gir forventede reaksjoner i to uker. Når vi ikke har falskt positive resultater, betyr høyere score at agglutinasjonene er sterkere med celler i Ec-Stabilizing solution. Selv om man skal være forsiktig med å bruke Wilcoxons test når dataene inneholder mange par som gir 0 i differanse, sees tilsvarende i den testen. Det er statistisk signifikant forskjell (p<0,0001) når alle prøvene sammenlignes og for Dag 1, mens det Dag 14 er statistisk signifikant forskjell (p = 0,0168) når cellene i Ec-Stabilizing solution er oppbevart i kjøleskap, og ingen signifikant forskjell når de er oppbevart i romtemperatur (p=0,2048) (Tabell 2 og 3).
Kan celler fortynnet med Ec-Stabilizing solution oppbevares i romtemperatur?
Passing & Bablok test viste ingen statistisk signifikant forskjell uavhengig av om vi så på alle prøvene, prøvene som ble analysert Dag 1 eller Dag 14, (Figur 3). I alle tilfellene omfattet 95 % av KI til konstanten 0.
Wilcoxons test for pardata viste at det var statistisk signifikant forskjell ved sammenligning av alle prøver (p=0,0328), mens det ikke var statistisk signifikant forskjell ved sammenligning av resultatene fra Dag 1 eller Dag 14 (Tabell 4). Den mest sannsynlige årsaken til denne forskjellen kan være det relativt høye antallet like differanser, da dette er en av svakhetene med Wilcoxons test for pardata.
Konklusjon
Analysering med celler i Ec-Stabilizing solution gir høyere score enn med celler fortynnet i PBS også når mange av antistoffen var fortynnet til å gi svake reaksjoner. I denne sammenhengen betyr en høyere score sterkere agglutinasjon, noe som gjør at analysen blir lettere å lese av og muligheten til å oppdage svake blodtypeantistoff kan bli større. Det er ingen signifikant forskjell på scoren om cellene i Ec-Stabilizing solution oppbevares i to uker, i romtemperatur eller kjøleskap. Selv om vi bare hadde fire antistoffer innen Kidd-systemet var resultatene overbevisende med tanke på at det er så stor sannsynlighet for å få sterkere agglutinasjon. Det sees ingen falsk positive reaksjoner. Ut fra disse funnene gikk BiO over til å bruke celler fortynnet med Ec-Stabilizing solution til IAT i glass.