Innledning
Glukosenivået i blodet stiger ved stress, akutt sykdom og kirurgiske inngrep og dette assosieres med flere endokrine og metabolske forstyrrelser (1). Hyperglykemi kan føre til økt dødelighet hos kritisk syke pasienter, og intravenøs insulinbehandling kan stabilisere glukosenivået hos denne pasientgruppen (2,3). Riktig insulindosering krever imidlertid hyppige glukosemålinger for å unngå hypoglykemi.
Behandlingsmål for pasienters glukosenivå er omdiskutert, men det er enighet om at hyppige glukosemålinger og rask tilgang til analysesvar for behandlende lege og sykepleier, er viktig. En slik effektiv og trygg glukosemonitorering er avhengig av at analysesvaret er riktig (1,4).
Monitorering av glukosenivået hos pasienter innlagt på sykehus blir utført både på blodgassinstrumenter, glukoseapparater for pasientnær analyse (PNA) og på laboratoriets hovedinstrument. Analysemetodene brukes til dels om hverandre i det daglige. Ved intensivavdelinger vil et blodgassinstrument med mulighet for glukosemåling være førstevalget. På den annen side er glukosemålingene ved hjelp av PNA-apparater godt innarbeidet ved norske sykehus, de er praktiske og gir mulighet for tett oppfølging av pasienten.
Analysekvaliteten for PNA glukose, vurdert ut i fra analytisk riktighet og presisjon, er metodeavhengig. Prøvetaking og måleteknikk må utføres riktig og analysekvaliteten må overvåkes med intern og ekstern kvalitetskontroll. Preanalytiske forhold knyttet til pasientens medisinske tilstand, som bruk av medikamenter, kan påvirke analyseresultatet. Kritisk syke pasienter får ofte mange medikamenter, de kan ha unormal erytrocyttvolumfraksjon (EVF) og unormal oksygenmetning, og slike faktorer påvirker glukosemålingene i større grad dersom de utføres på PNA blodsukkerapparater (5,6,7,8).
International Organisation for Standardization (ISO) anbefaler at 95 % av glukoseresultatene målt på PNA-apparater skal falle innenfor ± 0,83 mmol/L i forhold til sammenliknbar metode, når glukosekonsentrasjonen er under 4,2 mmol/L. Dersom glukosekonsentrasjonen er over 4,2 mmol/L, skal målingene falle innenfor ± 20 % (ISO 15197) (9). Kravene som stilles til analytisk riktighet og presisjon på pasientnære apparater er lavere enn kvalitetskravene som stilles til rutineanalyser på laboratoriet (6,7).
Medisinske beslutninger baseres på målte glukoseverdier, og krav til klinisk nøyaktighet vil variere i forhold til hvordan analysesvarene skal brukes. Glukose målt pasientnært kan ikke benyttes til å stille diagnosen diabetes (6).
Hensikten med vår undersøkelse var å sammenlikne glukoseverdier målt med forskjellige metoder hos kritisk syke pasienter, mens de ble behandlet intravenøst med glukose/insulin.
Vi valgte å teste ut to forskjellige PNA-apparater og ett blodgassinstrument, som alle ble sammenliknet med laboratoriets referansemetode for glukose målt i serum. Vi ønsket også å se effekten av EVF på glukosekonsentrasjon målt ved bruk av PNA-apparater.
Materiale og metode
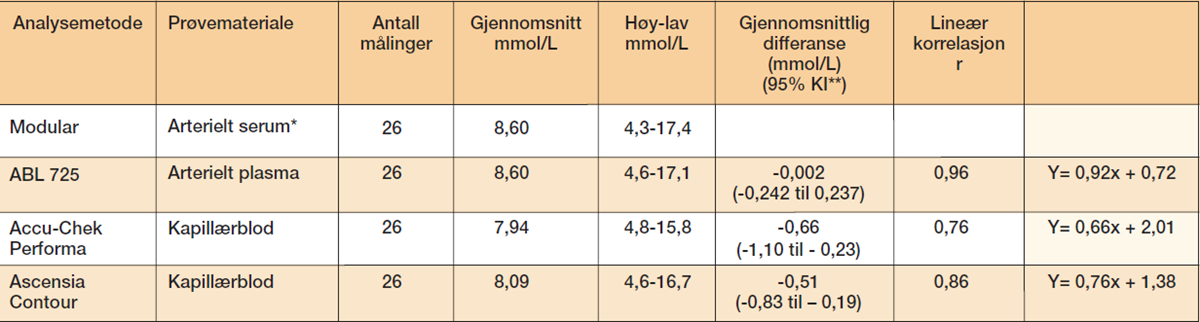
Pasienter innlagt ved hjerteavdelingen intensiv/overvåkning, medisinsk endokrinologisk avdeling og medisinsk nefrologisk avdeling ved Haukeland Universitetssykehus, ble inkludert i undersøkelsen. Glukosemålingene ble gjort i forbindelse med rutinemessige blodprøvetakinger. Alle pasientene hadde gitt muntlig samtykke til å delta. Undersøkelsen er et ledd i laboratoriets kvalitetssikring av prøvetaking og analysering. Derfor var det ikke nødvendig å søke Regional komité for medisinsk og helsefaglig forskningsetikk (REK) om godkjenning for å gjennomføre undersøkelsen. Alle pasientene fikk glukose/insulin intravenøst etter sykehusavdelingenes retningslinjer for behandling, enten via sentralt venekateter (SVK) (n=24), eller perifert venekateter (PVK) (n=2). Serum (s)-glukose (arterielt/venøst) ble målt på laboratoriets referanseinstrument, Modular (Roche Diagnostics, heksokinasemetode). Plasma (p)-glukose (arterielt/venøst) ble målt på blodgassinstrumentet ABL 725 (Radiometer, glukoseoksidasemetode). De pasientnære glukosemålingene ble utført på Accu-Chek Performa (Roche Diagnostics) og Ascensia Contour (Bayer HealthCare). Accu-Chek Performa bruker en glukosedehydrogenase-modifisert pyrroloquinolinequinone metode (GDH-PQQ modifisert metode) og Ascensia Contour bruker en flavin adenine dinucleotide glukosedehydrogenasemetode (FAD-GDH).
Prøvevolumet for begge PNA-apparatene er 0,6 µl. Resultatene utgis som kapillært plasma etter en automatisk omregning basert på en standardisert EVF-verdi på om lag 0,45.
Daglig kvalitetskontroll ble rutinemessig utført og godkjent for alle glukoseinstrumentene. Laboratoriets interne kvalitetskontroll viste at presisjonen for glukoseanalysen på Modular var 1,4 % i alle konsentrasjonsnivåer (3,3 mmol/L, 6,5 mmol/L og 19,8 mmol/L). På ABL 725 var presisjonen 4 % ved 1,3 mmol/L, 2 % ved 5,3 mmol/L og 1,5 % ved 13,6 mmol/L. For Ascensia Contour var presisjonen 2,1 % ved nivå 5,5 mmol/L. For Accu-Chek Performa var den 4,7 % ved 2,4 mmol/L og 4,2 % ved 15,7 mmol/L. Erytrocyttvolumfraksjon (EVF) ble målt på Cell-Dyn Sapphire (Abbot Diagnostics Divisjon).
Undersøkelsen strakte seg over fem måneder og prøvetakingene ble utført etter standardiserte prosedyrer og retningslinjer på sykehuset. Prøvetaking tatt fra arteriekran ble utført av mange forskjellige sykepleiere, mens de kapillære prøvetakingene ble utført av to bioingeniører. Prøvene ble tatt ved samme tidspunkt. Kapillær prøvetaking ble utført i finger og analysert umiddelbart på Accu-Chek Performa og Ascensia Contour. Alle målingene ble analysert med teststrimler fra samme produksjonsnummer. Hos pasienter med arteriekran, ble det tappet ett heparinrør (Na-Heparin, Terumo), ett gelrør (SST II, Becton Dickinson) og ett K2-EDTA rør (Greiner Bio-One). Heparinplasma ble brukt til å analysere glukose på blodgassinstrumentet ABL 725, innen 30 minutter etter prøvetaking. Blod i gelrør fikk koagulere i 30 minutter før sentrifugering og glukose i serum ble analysert på Modular. EVF ble analysert i blod fra K2-EDTA røret.
To pasienter uten arteriekran ble venepunktert i alburegionen og det ble tappet de samme tre rørene som hos pasientene med arteriekran. Totalt 26 sammenlikninger ble utført.
Statistiske metoder
Parvise glukosemålinger (n=26) på alle fire apparatene ble brukt i statistiske beregninger av resultatene. GraphPad Prism version 5.03 (GraphPad Software, San Diego California USA), er brukt for å sammenlikne måleresultatene i paret tosidig t-test. Lineær regresjonsanalyse ble brukt for å sammenlikne glukosemålingene utført på Modular og ABL 725.
Resultater
Glukoseresultatene er oppsummert og presentert som gjennomsnittsverdier for alle målingene i tabell 1.
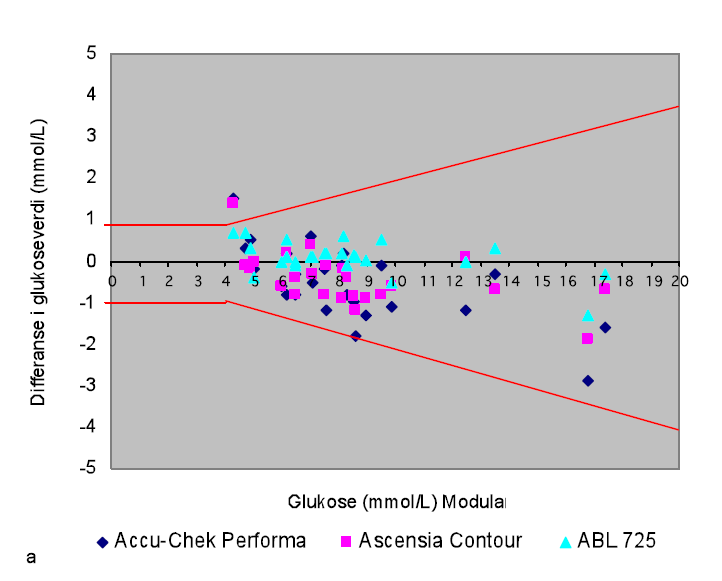
Differanseplottet (figur 1) viser spredningen i glukoseresultatene i forhold til laboratoriets referansemetode Modular. 88 % av glukoseresultatene målt på Accu-Chek Performa ligger innenfor + 20 % av laboratoriets referansemetode, mens 92 % av resultatene målt på Ascensia Contour ligger innenfor kravet om + 20 %.
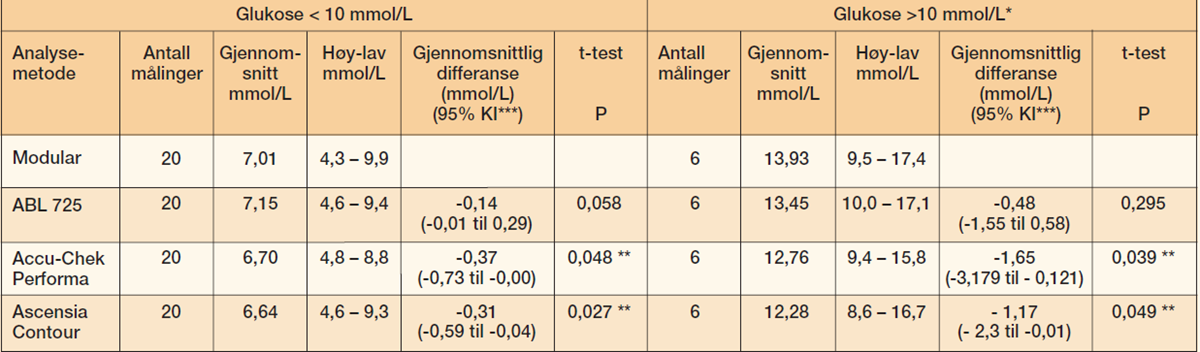
Tabell 2 viser sammenlikninger mellom de ulike måleinstrumentene fordelt på resultater mindre enn og større enn 10 mmol/L.
Resultatene viser at den gjennomsnittlige differansen er henholdsvis 0,37 mmol/L (5 %) og 0,31 mmol/L (4 %) for Accu-Chek Performa og Ascensia Contour når glukoseverdien er mindre enn 10 mmol/L. Den gjennomsnittlige differansen øker tilsvarende til 1,65 mmol/L (12 %) og 1,17 mmol/L (8 %) når glukosekonsentrasjonen er større enn 10 mmol/L. Paret t-test i begge konsentrasjonsområder viser at det var signifikante forskjeller i glukose målt pasientnært i kapillærblod og glukose målt i serum med laboratoriets referansemetode (p < 0,05) (tabell 2).
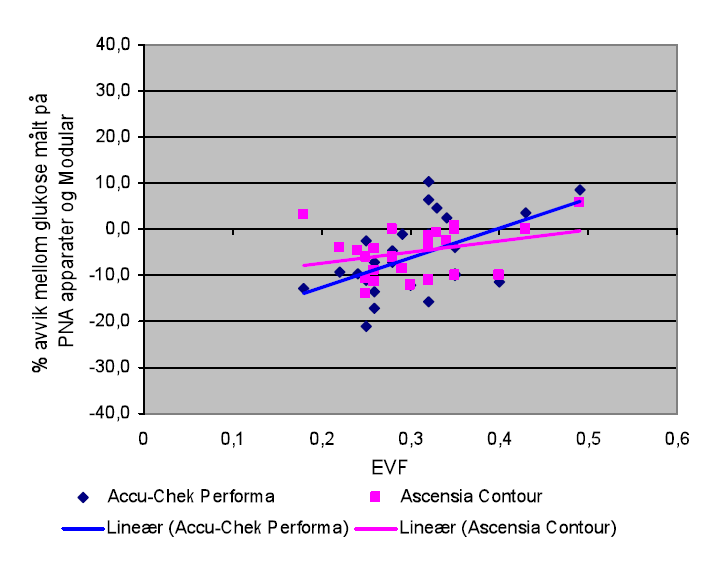
EVF viste en gjennomsnittlig verdi på 0,30, med en spredning fra 0,18 til 0,49. Produsentene anbefaler at Accu-Chek Performa kan brukes ved EVF mellom 0,10 og 0,65, mens Ascensia Contour er godkjent for bruk når EVF er mellom 0,0 og 0,70. Figur 2 viser en underestimering av glukose i snitt rundt 10 % når EVF er mindre enn 0,40. Underestimeringen avtar når EVF normaliseres. Utslaget er størst for Accu-Chek Performa.
Diskusjon
Optimal glukosemåling er viktig for å kunne gi pålitelig overvåking av pasienter som behandles med glukose/insulin. Nøyaktige glukoseverdier er helt avgjørende i det lave området (glukose < 4,0 mmol/L) da faren for hypoglykemi lett kan oppstå om pasienten får for mye insulin. Flere studier har evaluert effekten av insulininfusjon i forhold til tett oppfølging av glukosenivået hos kritisk syke pasienter (1-4). Nytten av denne behandlingen er omdiskutert dersom det er risiko for hypoglykemi på grunn av unøyaktige glukosemålinger (6,10,11).
Flere pasientnære glukoseapparater er beskrevet brukt i intensivavdelinger, og studiene viser motstridende resultater. Noen studier finner ingen signifikant forskjell når glukose måles kapillært og sammenliknes med laboratoriets referansemetode (12,13). Andre studier viser signifikant forskjell mellom referansemetode og PNA-metode, enten målt i kapillærblod eller blod fra SVK (11,14). PNA-apparater er vist å være mindre presise enn klinisk kjemiske analysemetoder, og det stilles derfor spørsmål om de er gode nok (6,7,15). For at pasienten skal få den påtenkte insulindosen og for å unngå feildosering med insulin, må glukoseapparatene gi presise og nøyaktige analyseresultater. Karon og medarbeidere har gjort en simuleringsstudie og viser at det tillatte + 20 % avvik mellom PNA-metode og referansemetoden vil kunne gi alvorlige feil i insulindoseringen. Forfatterne mener at dagens krav om at glukosemålinger utført på PNA-apparatene skal tilfredsstille + 20 %, ikke er optimal for kritisk syke pasienter som må ha tett glukoseoppfølging (11).
Glukosemålinger på Modular og ABL 725 ved vårt laboratorium viser sammenfallende resultater og god korrelasjon (r=0,96) (tab 1). Glukoseverdiene målt på PNA-apparatene (figur 1), viser at mindre enn 95 % av resultatene ligger innenfor kravene om + 20 % (ISO 15197), når glukoseverdien er større enn 4,5 mmol/L. Parvis t-test indikerer signifikante forskjeller mellom glukose målt på Modular og på Accu-Chek Performa og Ascensia Contour. Unøyaktighetene er rundt 10 % når glukoseverdien er større enn 10 mmol/L (Tabell 2). Underestimering av glukose kan føre til en økt risiko for at pasientene ikke får påvist hyperglykemi. Ved normale glukosekonsentrasjoner er differansen rundt 0,3 mmol/L (4 %). Denne differansen har sannsynligvis ikke klinisk betydning.
Det kan være problematisk å sammenlikne resultater med tidligere studier, fordi produktutviklingen går raskt og nye strimler kommer på markedet. Dette kan bety endringer i reagenssammensetningen på strimmelen. I tillegg kan lot-til-lot-variasjoner påvirke undersøkelsen. Flere studier vedrørende glukosemåling hos kritisk syke pasienter inneholder dessuten mangelfulle opplysninger om prøvetaking og analysemetode. I tilegg vil ulik studiedesign gjøre det vanskelig å sammenlikne resultatene (6,7).
Det må understrekes at de pasientnære glukoseapparatene er tiltenkt for monitorering av glukose hos pasienter med subkutan insulinbehandling og god allmenntilstand (16). Kapillærblod vil ofte ikke være det ideelle prøvematerialet når pasienten er kritisk syk, fordi pasienter kan ha en svekket perifer sirkulasjon eller fingerødem. Hudpunksjon kan i slike tilfelle føre til dårlig kvalitet på prøvematerialet med falske for lave resultater (6,8,16). I tillegg har denne pasientgruppen ofte lav EVF, noe som kan interferere på glukosemålinger utført på PNA-apparater (5,6). Vår studie viste gjennomsnittlig EVF på 0,30 (referanseverdi 0,35-0,50). EVF-verdiene er innenfor det området som leverandørene av PNA-apparatene anbefaler, men figur 2 viser en tydelig underestimering av glukose når EVF er mindre enn 0,40. Kritisk syke pasienter har ofte lav Hb og EVF (5,6,7). Våre resultater viser at produsentens plasmakorrigering for lave EVF-verdier ikke er optimal, og fører til underestimering av glukose med gjennomsnitt 10 %. Slik underestimering av glukose, som vi har påvist, kan være en viktig faktor som påvirker differansen mellom PNA-apparatene og Modular, og bidrar til at ikke alle målingene ligger innenfor + 20 %.
Generelt er glukosenivået høyere i arterieblod og kapillærblod, men lavere i veneblod. Forskjellene i glukoseverdier i ulike prøvematerialer er størst like etter et måltid (16). Pasientene i denne studien fikk intravenøs glukose kontinuerlig, og glukosekonsentrasjonen er derfor tilnærmet identisk i arterielt og venøst blod.
Begrensninger i undersøkelsen
Undersøkelsen er ikke en metodevalidering, men en klinisk studie som illustrerer hvordan ulike analysemetoder kan påvirke glukosemålingene. Glukose er en ustabil komponent og glykolyse vil redusere den målte glukosekonsentrasjonen med 5-7 % i løpet av en time, dersom ikke serum separeres fra blodlegemene. Preanalytiske forhold som koagulasjonstid, sentrifugering og prøvebehandling, vil kunne påvirke glukosesvaret (16). Målingene som er utført, er standardisert i henhold til sykehusets daglige rutiner for prøvetaking, prøvehåndtering og analysering og utført innen 30 minutter. Alle analysemetodene benyttes til daglig om hverandre ved glukosemonitorering. Studien representerer derfor glukoseverdier slik en vil oppleve det i klinikken.
Denne undersøkelsen er basert på et lite antall sammenlikninger (n=26), men likevel stort nok til å påvise signifikante forskjeller. Det mangler data i det lave glukosenivået (<4,2 mmol/L). Pasientene inkludert i denne studien fikk insulin og glukose intravenøst for å opprettholde et tilnærmet normalt glukosenivå. I et slikt klinisk materiale vil det derfor være umulig å få lave glukoseverdier.
Konklusjon
Undersøkelsen påviste at under standardiserte betingelser for prøvetaking, prøvehåndtering og analysering, kan vi påvise signifikante forskjeller mellom glukose målt pasientnært og på laboratoriets referanseinstrument Modular. Forskjellene øker ved høye glukosekonsentrasjoner. Resultatene viser at PNA apparatene ikke tilfredsstiller ISO 15197 om at 95 % av analyseresultatene skal ligge innenfor + 20 % sammenlignet med laboratoriets analysemetode. Lav EVF ser ut til å gi en underestimering av glukose til tross for at målingene ligger innenfor de EVF verdiene som produsentene anbefaler.
PNA-apparater er praktiske og enkle å betjene, men har lavere presisjon og nøyaktighet enn automatiserte laboratoriemetoder. Resultatene viser at PNA metoder må brukes med forsiktighet hos kritisk syke pasienter. For å hindre feilbehandling av denne pasientgruppen bør målinger i lavt glukosenivå kontrolleres med mer nøyaktige laboratoriemetoder.