Innledning
Sarkoidose er en kronisk betennelsessykdom uten kjent årsak. Den kan ramme ulike
organer/systemer, ofte lunge og hud, der vevet blir infiltrert av granulom. Typiske trekk ved sarkoidose er epiteloide granulomer og endret immunitet. Årsaken til granulomdannelse ved sarkoidose er ukjent, men histologisk sett likner sykdommen på tuberkulose.
Angiotensin Converting Enzyme (ACE, også kalt peptidyl-dipeptidase A eller kininase II) er et enzym som spiller en sentral rolle i Renin-Angiotensin-Systemet (RAS) hvor blodtrykket og elektrolyttbalansen reguleres. I RAS spalter renin angiotensinogen til inaktivt angiotensin I, som igjen spaltes av ACE til aktivt angiotensin II. På denne måten økes vasokonstriktor-aktiviteten (1). ACE finnes hovedsaklig som membranbundet enzym i endotelceller og i ulike typer epitelvev, som for eksempel epitelceller av proksimale tubuli, tarm og testikler. Frigjøring av ACE til blod skjer ved at ACE spaltes fra cellemembranen til sirkulasjonen. Ved sarkoidose spaltes ACE fra granulomenes epiteloide celler og gjenspeiler dermed granulom-massen (2) og sarkoidoseaktivitet. Serum-ACE (s-ACE) er forhøyet hos 40-80 prosent av personer med sarkoidose og kan benyttes som en markør for sarkoidoseaktivitet, samt ved diagnose og kontroll av sykdommen (2). Høy s-ACE-aktivitet ses også ved andre sykdommer, blant annet cirrhose, diabetes, hypertyroidisme, lungefibrose og tuberkulose (3).
Genet for ACE finnes på kromosom 17. Det inneholder en polymorfisme som består av en nukleotidsekvens på 287 basepar (bp) som enten er innskutt (insersjon, I), eller fraværende (delesjon, D) (4). Polymorfismen befinner seg i intron 16 av genet og gir opphav til tre ulike genotyper; DD (cirka 25 prosent), DI (cirka 50 prosent) og II (cirka 25 prosent). I tillegg til at nivået av ACE i serum påvirkes av sarkoidoseaktiviteten, avhenger s-ACE-nivået av genotypen (4). Genotypen DD gir høyere s-ACE-nivå enn DI- og II-genotypene (2, 4).
Et referanseområde bestemmes på grunnlag av en kvantitativ undersøkelse fra en definert gruppe friske eller syke individer etter bestemte regler. På den måten kan en pasients målte verdi vurderes i forhold til det aktuelle referanseområdet. De fleste referanseindivider er valgt ut ved en ikke-tilfeldig prosess og er ofte blodgivere eller sykehusansatte. Referanseområdet defineres oftest som det intervallet hvor verdiene til 95 prosent av en frisk befolkning ligger, det vil si mellom 2,5 og 97,5 persentilen. International Federation of Clinical Chemistry and laboratory medicine (IFCC) anbefaler bruk av interpersentil intervall som referanseområde.
Referanseområde kan bestemmes både ved hjelp av parametrisk og ikke-parametrisk statistisk metode. Parametrisk metode antar at referanseverdiene er normalfordelt, og er basert på median og standardavvik (SD). Referanseområde og referansegrenser bestemmes ved å beregne ± 2 SD fra medianen. Ikke-parametrisk metode antar ikke at referanseverdiene er normalfordelt. Referansegrenser bestemmes ved å fjerne 2,5 prosent av verdiene på hver ende av referansefordelingen. Når man sammenligner resultater fra de to metodene, er det liten forskjell på persentilene (3). Parametrisk metode er noe mer presis enn ikke-parametrisk metode. Ikke-parametrisk metode er enklere og foretrekkes ved bruk av “bootstrap” metode (3).
“Bootstrap” er en ikke-parametrisk metode som kan benyttes når fordelingen av referanseverdiene er usikker, og ved få referanseverdier. Ved å tilfeldig trekke en referanseverdi fra innsamlede data, registrere dens verdi og legge den tilbake, kan en sikrere fordeling oppnås. Behovet for innsamlede prøver blir mindre fordi trekking og tilbakelegging av prøver kan gjentas opptil tusen ganger (5).
I 2001 ble referanseområder for s-ACE delt på kjønn bestemt ved St. Olavs hospital i Trondheim ut fra analyse av blodgivere (122 menn og 85 kvinner). Det ble den gang ikke tatt hensyn til genotype. Målet med den studien som presenteres i denne artikkelen var å undersøke om det er grunnlag for å etablere genotypespesifikke referanseområder for s-ACE, som eventuelt kan benyttes til å gi mer nøyaktig diagnostisering, behandling og kontroll av sarkoidose. For å oppnå dette ble s-ACE målt hos 150 blodgivere av hvert kjønn, og DNA fra prøvene ble isolert og genotypet. Genotypespesifikke referanseområder ble beregnet ut fra innsamlede data.
Materiale og metode
Referansegruppe og prøveinnsamling
Serum til ACE-analyse og EDTA-blod til genotyping ble samlet fra 300 blodgivere (150 menn, 150 kvinner) ved Blodbanken på St. Olavs hospital. Prøvene ble anonymisert slik at bare kjønn, fødselsår og et løpenummer identifiserte prøvene. Blodgiverskjema ble benyttet for å innhente samtykke fra blodgiver.
Serum-ACE-analyse
Serum-prøvene ble analysert med hensyn til ACE aktivitetsnivå på ABX Pentra 400 (HORIBA ABX, Montpellier, Frankrike). Metoden baserer seg på spektrofotometrisk bestemmelse av hydrolyseringen av 3-(2-furylacryloyl)-L-phenylalanyl-glycyl-glycin (FAPGG) (6).
DNA-isolering
DNA ble isolert fra EDTA-blod ved hjelp av Dynabeads® DNA DIRECT™ Universal (DYNAL®, Invitrogen).
Genotyping
Genotyping av prøvene ble utført ved hjelp av PCR på LightCycler® 1.5, med LightCycler® FastStart DNA Master SYBR Green I (Roche). Primere var DI-Int 16 (5’- CTG-GAG-ACC-ACT-CCC-ATC-CTT-TCT-3’) og DI-Ex 16 (5’-GAT-GTG-GCC-ATC-ACA-TTC-GTC-AGA-T-3’) (Invitrogen Custom Primers). PCR-programmet bestod av en innledende denaturering ved 95 °C i 10 minutter, etterfulgt av 35 sykler med denaturering i 95 °C i 15 sekunder; annealing 50 °C i 15 sekunder; extension 72 °C i 10 sekunder.
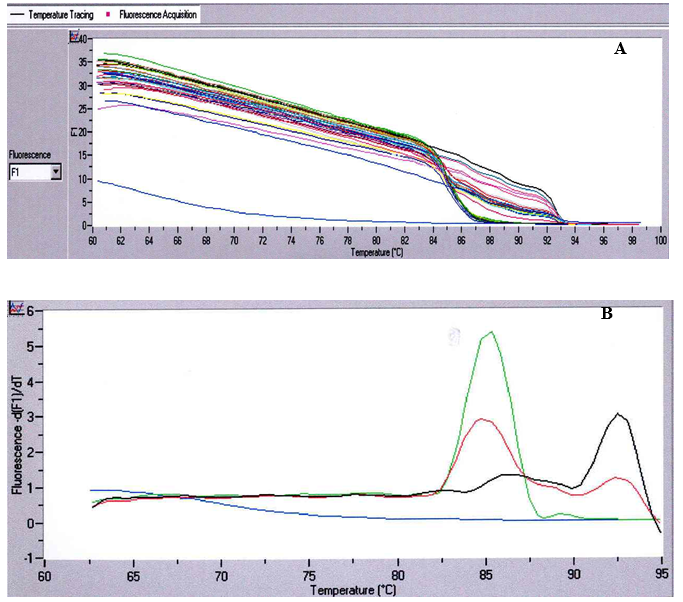
LightCycler lager til slutt en smeltekurve ved å øke temperaturen fra 60 °C til 95 °C (figur 1).
Statistiske metoder
Referanseområder ble beregnet med ikke-parametrisk metode ved bruk av MedCalc® (Mariakerke, Belgia), mens 90 prosent konfidensintervall for hver referansegrense, som anbefalt av IFCC (7), ble beregnet med bootstrap-metodikk ved hjelp av RefVal 4.10 (8).
Mann-Whitney test ble benyttet for å undersøke om det var statistisk signifikant forskjell mellom medianene til kvinner og menn, og mellom de ulike ACE-genotypene.
Resultater og diskusjon
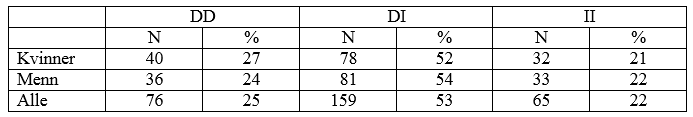
Vellykket genotyping ble gjennomført for alle 300 prøvene. Som vist i Tabell 1 var genotypene fordelt slik at DD-genotypen utgjør cirka 25 prosent, DI-genotypen utgjør cirka 50 prosent og II-genotypen utgjør cirka 25 prosent. Det var ingen forskjell mellom kvinner og menn i distribusjon av genotyper, noe som først ble antatt (St. Olavs hospital bruker et kjønnsdelt referanseområde). Disse resultatene tilsvarer det som er funnet i andre studier (2, 4).
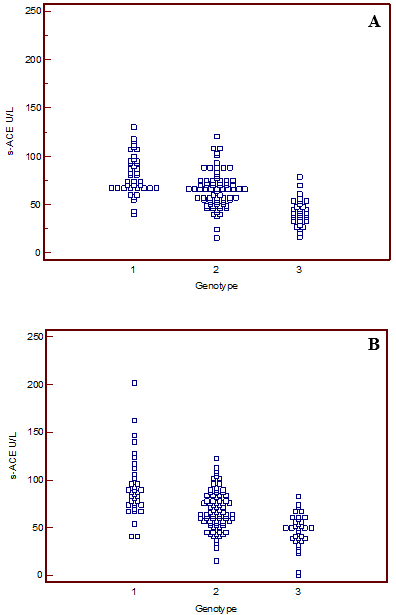
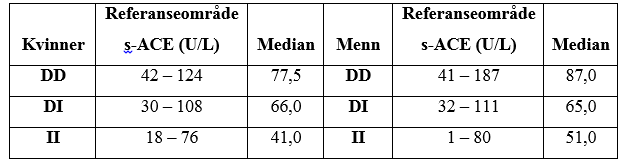
Som vist i Figur 2 gir genotypen DD høyere s-ACE-verdier enn DI- og II-genotypene hos både kvinner og menn. II-genotypens s-ACE-verdier ligger lavest, mens s-ACE-verdiene til genotypen DI ligger mellom verdiene til DD og II-genotypene. Dette er i tråd med tidligere undersøkelser (2, 4). Referanseområdet for s-ACE ved St. Olavs hospital, er i dag kjønnsdelt. Det ble derfor antatt at det ville være forskjell på kvinner og menns ACE-verdier også etter inndeling i de ulike genotypene. Ved Mann-Whitney test ble det ikke funnet statistisk signifikant forskjell mellom kvinners og menns medianverdier i serum-ACE nivå for hver av de ulike genotypene (Tabell 2). Det bør derfor vurderes å ta i bruk et felles genotypespesifikt referanseområde for kvinner og menn. Imidlertid var det statistisk signifikant forskjell mellom genotypenes medianverdier (Mann-Whitney test, p < 0,05) for både kvinner og menn. Tabell 3 viser nedre og øvre referansegrenser for ACE-genotypene med 90 prosent konfidensintervall.
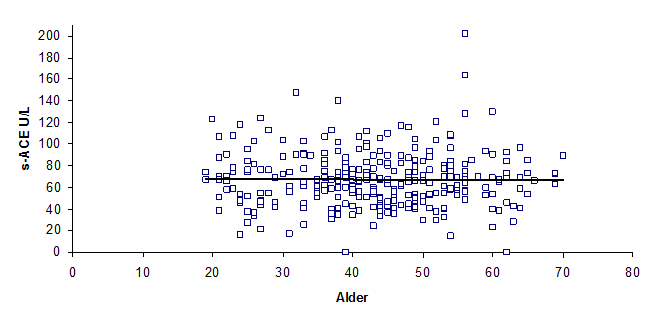
Det ble også undersøkt om s-ACE endrer seg med alderen. Figur 3 viser at s-ACE ikke forandres med alder i referansegruppen. Mangel på verdier før fylte 20 år skyldes at det i Norge er 18 års aldersgrense for å bli blodgiver.
Når et referanseområde skal bestemmes, kan det benyttes statistiske metoder for å detektere slengere (”outliers”), verdier som viser stort avvik fra median. Slike verdier ble påvist ved hjelp av RefVal 4.10. Man kan derfor spekulere i om slengerne påvirker fordelingen av verdiene slik at andre referanseområder ville framkommet om slengerne var fjernet. Sammenligning av referanseområdene med og uten slengere viste imidlertid liten forskjell. I tillegg ble det undersøkt om det fortsatt var forskjell mellom genotypenes medianer etter fjerning av slengere. Mann-Whitney test viser at det fortsatt er statistisk signifikant forskjell. Etter anbefaling fra IFCC om ikke å fjerne slengere automatisk, og mangel på biologiske og biokjemiske grunner for å fjerne verdiene fra datasettet, ble alle verdiene beholdt.
Ideelt sett bør en referansegruppe bestå av en større gruppe individer som ikke er forhåndsselektert, og bør velges uten å ta hensyn til helsetilstand slik at referanseområdet best mulig kan representere befolkningen. Blodgivere representerer den friskeste delen av befolkningen med veldefinert helsetilstand, og er lett tilgjengelig. Pasienters målte verdier blir dermed sammenlignet med verdier fra de friskeste, når diagnose og behandlingseffekt skal vurderes. Nytten av denne sammenligningen er ukjent, men det antas at de ideelle kliniske beslutningsgrensene for å avgjøre sykdomsbildet til en pasient, ikke vil være lik referansegrensene. Ut fra en samlet vurdering synes det imidlertid riktig å definere egne referanseområder for de tre ACE-genotypene.
Konklusjon
Det kan i denne studien konkluderes med at det er statistisk grunnlag for å etablere genotypespesifikke referanseområder for s-ACE uavhengig av kjønn og alder. Flere punkter kan studeres nærmere med tanke på størrelse og valg av referansegruppe, samt betydningen av slengere på referanseområdene. Det bør også undersøkes om etablering av genotypespesifikke referanseområder for s-ACE vil ha positiv effekt for diagnostisering, behandling og kontroll av pasienter med sarkoidose.